内蒙古自治区第二类医疗器械注册流程和要求
发布日期:2020-08-04 18:04浏览次数:5749次
内蒙古自治区第二类医疗器械注册流程和要求,详见正文。
引言:内蒙古自治区第二类医疗器械注册流程和要求,详见正文。

一、内蒙古自治区第二类医疗器械注册受理条件:
1.已在内蒙古自治区辖区内依法登记的企业。 2.已确定申报产品为第二类医疗器械,申报注册的产品已经列入《医疗器械产品分类目录》的第二类医疗器械或者国家总局界定文件中明确为第二类医疗器械的产品;对于新研制的尚未列入分类目录的医疗器械,经国家总局确认为二类医疗器械的产品。 3.已具备拟注册产品的生产能力,按照医疗器械生产质量管理规范的相关要求建立与产品研制、生产有关的质量管理体系并保持有效运行; 申请注册时样品不得委托其他企业生产,按照创新医疗器械特别审批程序审批的产品除外。 4.办理医疗器械注册申请的人员具有相应的专业知识,熟悉医疗器械注册管理的法规、规章和有关的技术要求。 5.申请人申请注册,应当遵循医疗器械安全有效基本要求,保证研制过程规范,所有数据真实、完整、可溯源。 6.申请注册的资料应当使用中文。根据外文资料翻译的,应当同时提供原文。引用未公开发表的文献资料时,应当提供资料所有者许可使用的证明文件。申请人对资料的真实性负责。 7.申报资料齐全,符合申报材料要求及相关法律法规的规定条件。 8.对于国家食品药品监督管理总局已发布相应产品注册技术指导原则,申请人应参照执行。
二、内蒙古自治区第二类医疗器械注册流程:
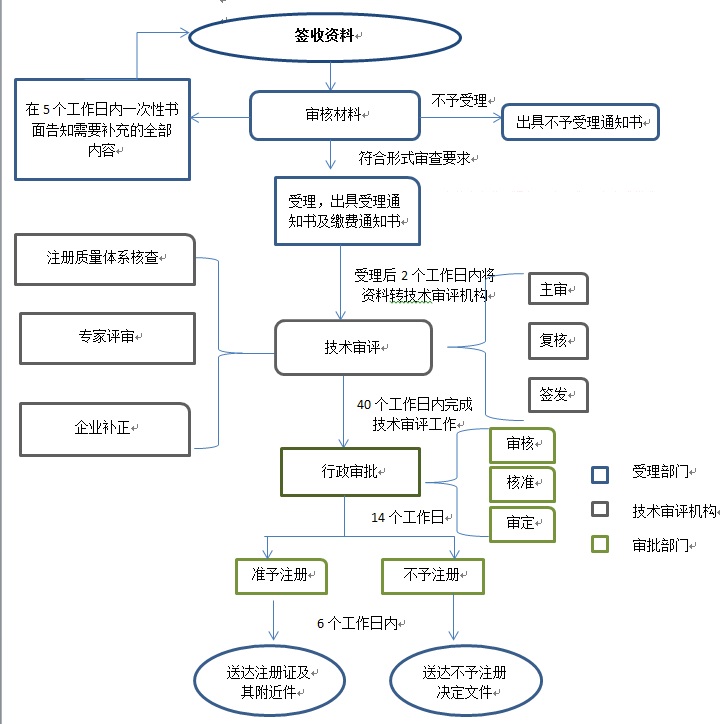
上一篇:没有了
下一篇:没有了