医疗器械产品技术要求编号:XXXXXXXXX
一次性使用无菌导尿管
1.产品型号/规格及其划分说明
1.1组成结构
一次性使用无菌导尿管(以下简称:导尿管)分为单腔、两腔和三腔。结构见图1-图3。
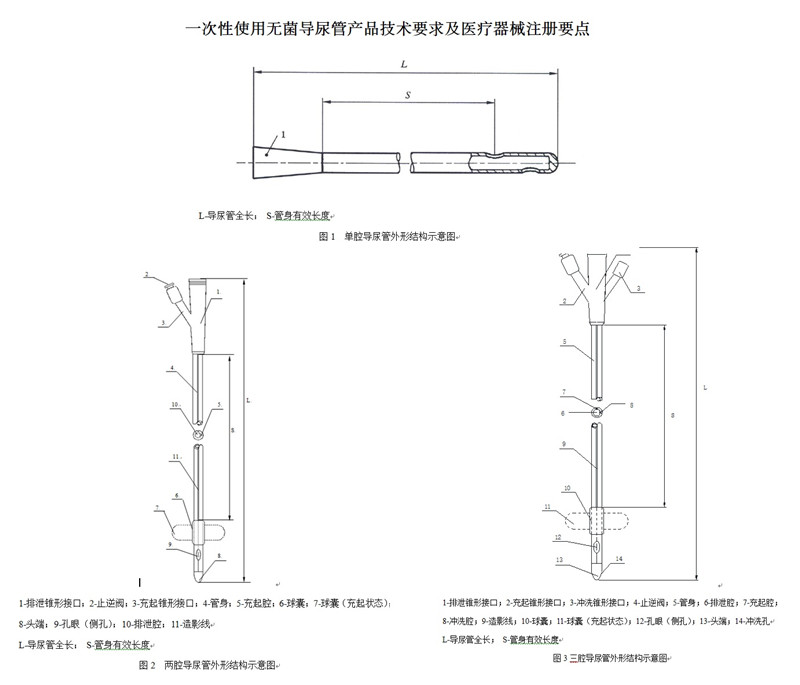
1.2型号规格
导尿管的型号规格见表1。
表1导尿管型号规格表
型号 | 规格 | 公称外径(Φ)/mm ±0.33 | 导尿管 标称全长(L)/mm ±50 | 有效长度(S)/mm | 球囊容积 /ml |
|
|
|
|
|
|
 1.3材料
1.3材料
导尿管的部件所用的材料见表2。
表2导尿管构成部件材料表
2.性能指标
2.1外观
管身、尖部、球囊和孔眼应无外来物质,且不应有加工缺陷和表面缺陷。
2.2尺寸
导尿管应用其公称外径(mm)表示其规格,精确到0.1mm。其公差应为±0.33mm。球囊容积应以毫升(ml)表示。
球囊导尿管的管身外径、全长、有效长度、球囊容积应符合表1的规定。
2.3强度
当按YY 0325-2016附录A所给方法试验时,尖部和锥形接口应与管身连为一体,管身应无断裂。
2.4连接器分离力
当按YY 0325-2016附录B所给方法试验时,排泄锥形接口应不与试验连接器分离。
2.5球囊可靠性
2.5.1当按YY 0325-2016附录C所给方法试验时,球囊应无泄露,并且不应影响排泄孔。
2.5.2当按YY 0325-2016附录D所给方法试验时,水的回收率应不低于表3的规定值。
表3球囊试验回收百分率
公称球囊容积 ml | 试验体积回收最小百分比 % |
3 5 10 15 20 30及以上 | 50 55 75 75 80 80 |
2.6耐弯曲性
按YY 0325-2016附录E试验时,弯曲导尿管各腔的液体流量应不低于平直导尿管液体流量的50%。
2.7流量
向球囊中充入公称容积的蒸馏水,按GB/T 15812.1-2005中附录E所给方法试验时,流量应符合表4规定。
表4平均流量
标称规格 | 平均流量(最小值) |
外径(mm) | 规格(Fr) | 排泄腔(mL/min) | 冲洗腔(mL/min) |
2.0 | 6Fr | 10 | 不适用 |
2.7 | 8Fr | 15 | 不适用 |
3.3 | 10Fr | 30 | 不适用 |
4.0 | 12Fr | 50 | 不适用 |
4.7 | 14Fr | 70 | 25 |
5.3 | 16Fr | 100 | 25 |
6.0 | 18Fr | 100 | 25 |
6.7 | 20Fr | 100 | 25 |
7.3 | 22Fr | 100 | 30 |
8.0 | 24Fr | 100 | 30 |
8.7 | 26Fr | 100 | 30 |
9.3 | 28Fr | 100 | 不适用 |
10.0 | 30Fr | 100 | 不适用 |
2.8无菌
产品应无菌。
2.9耐腐蚀性(如适用)
如有金属部件,按GB/T 15812.1-2005中附录A进行试验时,试样应无腐蚀迹象。
2.10 化学性能
2.10.1环氧乙烷残留量(如适用)
环氧乙烷残留量应不大于10μg/g。
2.10.2酸碱度
检验液与同批空白对照液相比,pH值之差不得超过2.0。
2.10.3重金属含量
检验液重金属总含量不超过5μg/ml。
2.10.4还原物质
检验液与空白液消耗浓度为0.002mol/L高猛酸钾溶液的体积之差应不超过2.0ml。
2.10.5蒸发残渣
蒸发残渣总量不超过2.0mg。
2.11涂层表面滑动性能(如适用)
按YY/T 1536-2017所给方法试验,滑动性能的试验力值应符合制造商的规定。
3.检验方法
3.1外观
手感,目测,结果应符合2.1的要求。
3.2尺寸
用通用或专用量具测量,结果应符合2.2的要求。
3.3强度
按YY 0325-2016附录A所给方法进行试验,结果应符合2.3的要求。
3.4连接器分离力
按YY 0325-2016附录B所给方法进行试验,结果应符合2.4的要求。
3.5球囊可靠性
3.5.1按YY 0325-2016附录C所给方法进行试验,结果应符合2.5.1的要求。
3.5.2按YY 0325-2016附录D所给方法进行试验,结果应符合2.5.2的要求。
3.6耐弯曲性
按YY 0325-2016附录E的方法进行试验,结果应符合2.6的要求。
3.7流量
按GB/T 15812.1-2005中附录E所给方法进行试验,结果应符合2.7的要求。
3.8无菌
按中华人民共和国药典(2020年版四部)的方法进行检验,结果应符合2.8的规定。
3.9耐腐蚀性试验(如适用)
按GB/T 15812.1-2005中附录A的方法进行试验,结果应符合2.9的要求。
3.10化学性能
3.10.1环氧乙烷残留量(如适用)
按GB/T 14233.1-2008中规定的方法进行测试,结果应符合2.10.1的要求。
3.10.2酸碱度试验
取检验液,按GB/T 14233.1-2008中5.4.1规定的方法进行,结果应符合2.10.2的要求。
3.10.3重金属总含量试验
取检验液,按GB/T 14233.1-2008中5.6.1规定的方法进行,结果应符合2.10.3的要求。
3.10.4还原性物质试验
取检验液,按GB/T 14233.1-2008中5.2.2规定的方法进行,结果应符合2.10.4的要求。
3.10.5蒸发残渣试验
取检验液,按GB/T 14233.1-2008中5.5规定的方法进行,结果应符合2.10.5的要求。
3.11 涂层表面滑动性能(如适用)
按YY/T 1536-2017所给方法试验,应符合2.11的要求。
如有一次性使用无菌导尿管产品技术要求及医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:吕工,电话:18058734169,微信同。