适用于动静脉瘘的建立的人工血管在我国属于第三类医疗器械注册产品,该产品为多层结构,在膨体聚四氟乙烯(ePTFE)内层 和聚对苯二甲酸乙二醇酯(PET)编结物外层之间,有加强型聚丙烯(PP)支撑环和硅胶层。环氧乙烷灭菌,一次性使用。本文为大家介绍人工血管产品技术要求及注册审评要点,一起看正文。
适用于动静脉瘘的建立的人工血管在我国属于第三类医疗器械注册产品,该产品为多层结构,在膨体聚四氟乙烯(ePTFE)内层
和聚对苯二甲酸乙二醇酯(PET)编结物外层之间,有加强型聚丙烯(PP)支撑环和硅胶层。环氧乙烷灭菌,一次性使用。本文为大家介绍人工血管产品技术要求及注册审评要点,一起看正文。
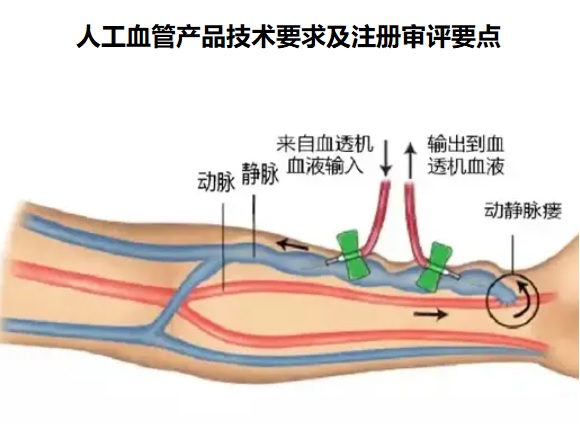
一、人工血管的工作原理
人工血管是一种非来源于自然器官和组织的血管代用
品,人工血管可用于血液透析患者的动静脉通路建立,在血
液通路手术中作为皮下动静脉通路。
二、人工血管产品技术要求
人工血管产品技术要求中的性能指标通常用包括:外观、自然状态下内径、有效长度、壁厚、水渗透压、轴向拉伸强度、圆周拉伸强度、探针破裂强度、牵拉强度、反复穿刺后圆周拉伸强度、扭结半径、扩张内径、动态顺应性、微粒污染、单位面积重量、还原物质、蒸发残渣、紫外吸光度、酸碱度、重金属总量、环氧乙烷残留量、六甲基二硅氧烷残留量、无菌、细菌内毒素这24项性能指标。
三、人工血管产品注册时,生物相容性试验应开展哪几项?
人工血管为植入器械,与人体循环血液长期接触。医疗器械注册申请人依据 GB/T 16886 系列标准进行了生物相容性评价,选择了材料表征、毒理学评价和生物学试验的方式进行风险评定,开展的生物学试验包括溶血、血栓形成、凝血、热原、急性全身毒性、细胞毒性、致敏、皮内反应、植入后局部组织反应、遗传毒性、亚慢性全身毒性;针对亚急性毒性、慢性毒性、致癌性终点开展了评价。
如有人工血管产品注册咨询服务需求,或是其他第三类医疗器械注册代理服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。