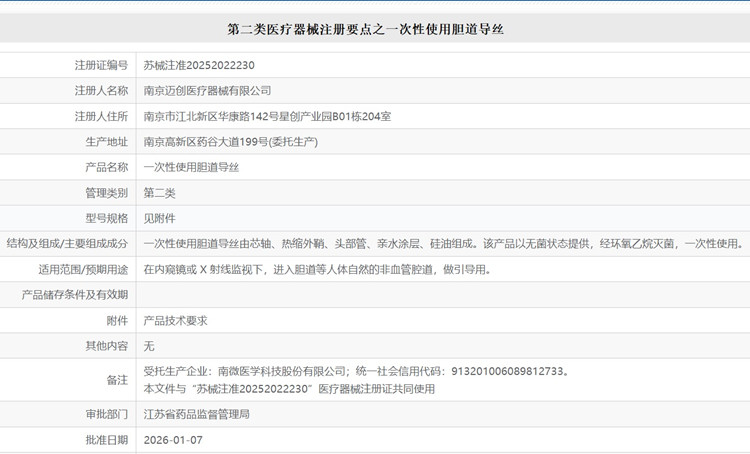
一次性使用胆道导丝由芯轴、热缩外鞘、头部管、亲水涂层、硅油组成。该产品以无菌状态提供,经环氧乙烷灭菌,一次性使用。在内窥镜或 X 射线监视下,进入胆道等人体自然的非血管腔道,做引导用。一次性使用胆道导丝在我国属于第二类医疗器械注册产品,本文为大家介绍一次性使用胆道导丝注册要点,一起看正文。
一次性使用胆道导丝由芯轴、热缩外鞘、头部管、亲水涂层、硅油组成。该产品以无菌状态提供,经环氧乙烷灭菌,一次性使用。在内窥镜或 X 射线监视下,进入胆道等人体自然的非血管腔道,做引导用。一次性使用胆道导丝在我国属于第二类医疗器械注册产品,本文为大家介绍一次性使用胆道导丝注册要点,一起看正文。
第二类医疗器械注册要点之一次性使用胆道导丝
(一)一次性使用胆道导丝工作原理:一次性使用胆道导丝在内窥镜或X射线监视下,进入或引导其他设备进入胆管、胰管等自然腔道的预定位置,起到引导作用。
(二)一次性使用胆道导丝生物学评价:跟人体自然腔道部位接触,符合生物学评价的要求。
(三)一次性使用胆道导丝灭菌工艺: 1.该产品以无菌状态提供。 2.该产品采用环氧乙烷灭菌,灭菌工艺经确认和验证,灭菌过程对产品性能不产生影响,灭菌后能达到无菌要求。
(四)一次性使用胆道导丝临床评价: 该产品列入《免于临床评价医疗器械目录》,属于免于进行临床评价的医疗器械。将申报产品与已获准境内注册的胆道用斑马导丝进行同品种对比,申报产品与同品种产品在基本原理、结构组成、与人体接触部分的制造材料、性能要求、适用范围、使用方法、灭菌/消毒方式等方面基本等同,差异部分不会对产品的安全性和有效性产生不利影响。
如有医疗器械注册、一次性使用胆道导丝注册、医疗器械临床评价咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:吕工,电话:18058734169,微信同。