激光器产品技术要求中升级标准年代号,是否需要检验报告?
发布日期:2026-01-22 00:00浏览次数:25次
激光类医疗器械注册产品是医疗器械家族的重要分支,广泛应用于碎石、泌尿、医美、理疗等方方面面,由于GB/T 7247.1-2024 《激光产品的安全 第1部分设备分类和要求》已代替GB 7247.1-2012《激光产品的安全 第1部分:设备分类、要求》,医疗器械注册人需要做哪些工作?一起看正文。
激光类医疗器械注册产品是医疗器械家族的重要分支,广泛应用于碎石、泌尿、医美、理疗等方方面面,由于GB/T 7247.1-2024 《激光产品的安全 第1部分设备分类和要求》已代替GB 7247.1-2012《激光产品的安全 第1部分:设备分类、要求》,医疗器械注册人需要做哪些工作?一起看正文。
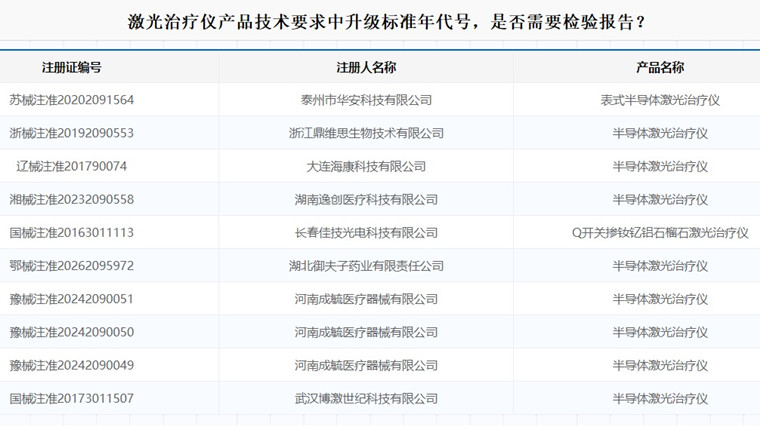
GB/T 7247.1-2024 《激光产品的安全 第1部分设备分类和要求》已代替GB 7247.1-2012《激光产品的安全 第1部分:设备分类、要求》,产品技术要求中升级该标准年代号,是否需要检验报告?
已上市产品未发生变化,仅产品技术要求中引用的GB 7247.1-2012修订为GB/T 7247.1-2024,需提供新旧标准中相应要求和检验方法条款的详细对比说明及支持性资料,以及新旧标准对产品所含激光类别的判定资料,若均未发生实质性变化,则无需提供针对该标准年代号升级的检验报告。
如有半导体激光治疗仪注册、激光器注册、医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:吕工,电话:18058734169,微信同。