?用于扩张鼻孔,缓解鼻塞用的通气鼻贴在我国属于第二类医疗器械注册产品。近日,国家药监局发布《通气鼻贴注册审查指导原则(征求意见稿)》,本文为大家介绍通气鼻贴产品技术要求及医疗器械注册审查要点,一起看正文。
用于扩张鼻孔,缓解鼻塞用的通气鼻贴在我国属于第二类医疗器械注册产品。近日,国家药监局发布《通气鼻贴注册审查指导原则(征求意见稿)》,本文为大家介绍通气鼻贴产品技术要求及医疗器械注册审查要点,一起看正文。
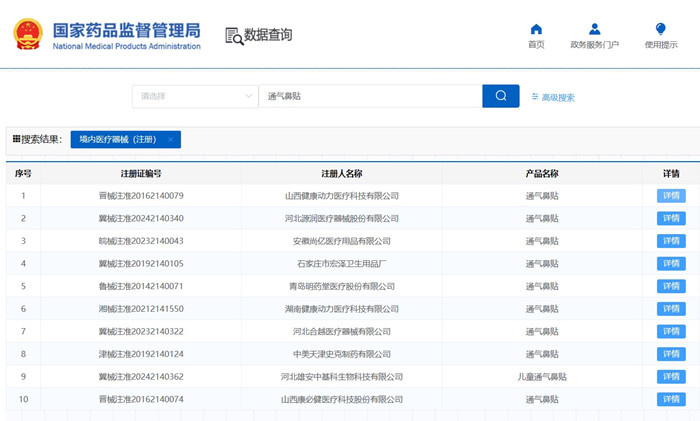
一、通气鼻贴产品结构组成与工作原理
1.通气鼻贴产品的结构和组成
通气鼻贴产品通常由表面材料、医用压敏胶、弹性片、基本材料、离型纸组成,不含药。
2.通气鼻贴产品工作原理
通气鼻贴将具有弹性的塑料片通过强力胶和基布固定在鼻梁部位,供扩张鼻孔,辅助缓解鼻塞用。
二、通气鼻贴产品技术要求及检验报告
产品技术要求的制定应符合《医疗器械产品技术要求编写指导原则》的要求。申请人应依据产品的技术特征和临床使用情况来确定产品安全有效的技术指标和检验方法。本指导原则给出通气鼻贴需要考虑的产品基本技术性能指标,申请人根据自身产品的技术特点和用途制定相应的性能指标,且性能指标不得低于强制性国家标准、行业标准。
2.1产品型号/规格及其划分说明
明确产品型号/规格,阐明各型号/规格间的区别及划分说明,型号/规格的表述应与全部注册申报资料保持一致,并提供结构示意图。
2.2性能指标
通气鼻贴产品性能指标至少应包括以下几点:
2.2.1外观及尺寸;
2.2.2剥离强度;
2.2.3持粘性;
2.2.4剥离残留物;
2.2.5弹性片弹性及持续时间;
2.2.6无菌(如适用);
2.2.7微生物限度(如适用);
2.2.8化学性能;
根据不同材料特性,由企业决定具体的化学性能要求(如:酸碱度等,具体指标的选择可以参照相应的国家、行业标准及已上市同类产品情况)。用环氧乙烷灭菌的产品应规定环氧乙烷残留量的要求。
2.2.9根据产品宣称的技术特点制定的其他性能要求。
2.3检验报告
2.3.1同一注册单元内所检验的产品应当是能够代表本注册单元内其他产品安全性和有效性的典型产品,其功能最齐全、或结构最复杂、或风险最高。其他型号可进行差异性检测。
2.3.2典型产品的确定可以通过比较同一注册单元内所有产品的技术结构、性能指标等相应资料,说明其能够代表本注册单元内其他产品的安全性和有效性。
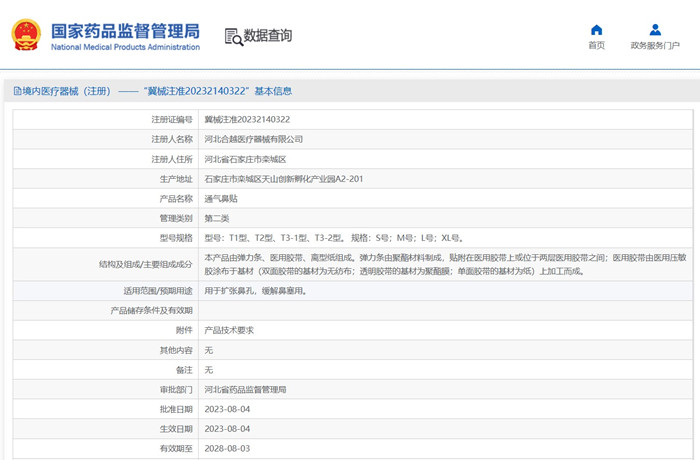
三、通气鼻贴注册审查要点
3.1通气鼻贴生物学特性研究
按照GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》、《关于印发医疗器械生物学评价和审查指南的通知》要求开展生物相容性评价,生物相容性评价研究资料应当包括:生物相容性评价的依据、项目和方法;产品所用材料的描述及与人体接触的性质和时间;实施或豁免生物学试验的理由和论证;对于现有数据或试验结果的评价。
本指导原则中的通气鼻贴属于与完好皮肤长期接触(>24小时,≤30天)的表面接触器械,开展生物学评价,应按照GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》标准进行评价,至少应包括细胞毒性、刺激反应、致敏反应等。
3.2通气鼻贴灭菌工艺研究
如产品无菌供应,应明确灭菌工艺(方法和参数)及其选择依据和无菌保证水平(SAL),并提供灭菌确认报告,无菌保证水平(SAL)应保证达到1×10-6。灭菌过程的选择应至少考虑以下因素:产品与灭菌过程的适应性;包装材料与灭菌过程的适应性;灭菌对产品安全有效性的影响。
若灭菌使用的方法容易出现残留,如环氧乙烷灭菌,应当明确残留物信息及采取的处理方法,并提供环氧乙烷解析的研究资料。
如有通气鼻贴注册或其它医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。