用于鼻腔的检查的一次性使用鼻镜在临床上广泛应用,尽管用于自然腔道检测,一次性使用鼻镜多数仍然是无菌状态提供,降低了患者检查过程中的感染风险,也减少了重复使用器械的灭菌消毒工作。本文为大家介绍一次性使用鼻镜产品技术要求及医疗器械注册审查要点,一起看正文。
用于鼻腔的检查的一次性使用鼻镜在临床上广泛应用,尽管用于自然腔道检测,一次性使用鼻镜多数仍然是无菌状态提供,降低了患者检查过程中的感染风险,也减少了重复使用器械的灭菌消毒工作。本文为大家介绍一次性使用鼻镜产品技术要求及医疗器械注册审查要点,一起看正文。
一、一次性使用鼻镜产品设计开发
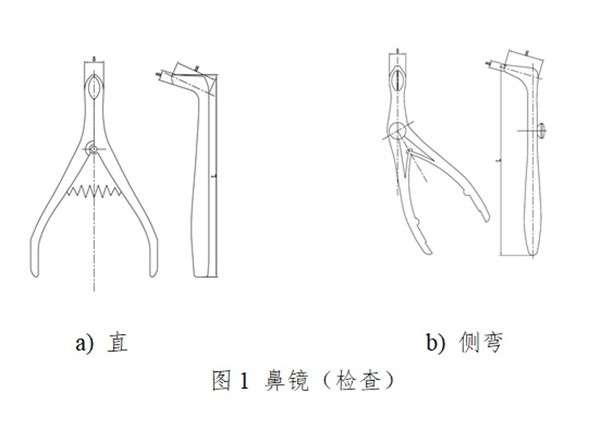
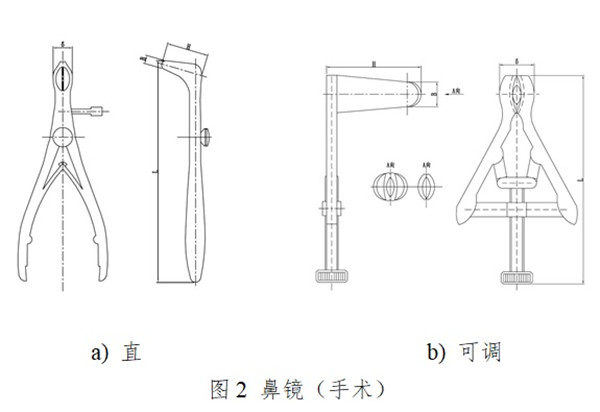
一次性使用鼻镜包括检查鼻镜和手术鼻镜。检查鼻镜供鼻腔检查用,手术鼻镜供鼻腔及鼻甲作检查及手术用。通常由左片、右片、销(螺钉)、弹簧组成,无菌提供。产品按第二类医疗器械管理,分类编码为07-01-03。
一次性使用鼻镜设计开发应以临床为导向,应能保证一次性使用鼻镜扩展并暴露视野,满足医生进行观察检查及(或)手术用时的安全和有效。产品设计开发和生产过程应保证产生的析出物(包括可沥滤物和/或蒸发物)、降解产物、加工残留物等降低到可接受水平,为患者提供最大程度的安全保障。产品设计开发应考虑医疗器械可用性工程的要求。产品的使用应符合临床操作规范及卫生行政主管部门的规定。
二、一次性使用鼻镜注册单元划分
一次性使用鼻镜注册单元划分原则上以产品的技术原理、主要结构组成、性能指标和适用范围为划分依据,满足《医疗器械注册单元划分指导原则》相关要求。
产品的适用范围不同时,原则上划分为不同的注册单元。如检查鼻镜、手术鼻镜应划分为不同注册单元。产品的关键组件结构差异导致适用范围和/或性能要求不同时,原则上划分为不同的医疗器械注册单元。
三、一次性使用鼻镜产品技术要求
一次性使用鼻镜产品技术要求建议参考 YY/T 0189《鼻镜》等相关标准,结合产品设计特征及临床应用来制订,同时还需符合《医疗器械产品技术要求编写指导原则》的要求。
产品技术要求中应明确型号规格及其划分说明、产品性能指标及检验方法、产品描述一般信息(原材料、结构组成、结构示意图等)。
产品性能指标应不低于产品适用的强制性国家标准/行业标准,若申报产品不适用强制性标准,提供说明以及经验证的证明性资料。如产品有特定设计,申请人还应根据产品设计特征设定相应的性能指标,并将其列入产品技术要求。
(1)产品型号/规格及其划分说明
明确产品型号/规格,阐明各型号/规格间的区别及划分说明,型号/规格的表述应与全部注册申报资料保持一致,并提供结构示意图。
(2)性能指标
鼻镜产品性能指标至少应包含外观、尺寸、使用性能、硬度(如适用)、表面粗糙度(如适用)、耐腐蚀性(如适用)、反复开合无断裂、无菌、化学性能(如适用)、环氧乙烷残留量(如适用)等。
(3)检验方法
产品的检验方法需优先采用国家标准/行业标准中的方法。对于相关国家标准/行业标准中不适用的条款,需说明不适用的原因。所有引用的标准注明其编号、年号或版本号。必要时可以附录形式采用相应图示进行说明,文本较大的可以附录形式提供。
如有一次性使用鼻镜产品技术要求编写或是医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。