人乳头瘤病毒(HPV)核酸检测及基因分型试剂是指利用包括PCR-荧光探针法或其他分子生物学方法在内的核酸检测技术,以特定高危型HPV核酸(包括DNA和RNA)序列为检测目的,对人宫颈脱落上皮细胞进行体外定性检测的试剂,以确定受试样本中是否存在高于阳性判断值水平的高危型HPV病毒,或同时鉴定感染HPV的基因型别。
人乳头瘤病毒(HPV)核酸检测及基因分型试剂是指利用包括PCR-荧光探针法或其他分子生物学方法在内的核酸检测技术,以特定高危型HPV核酸(包括DNA和RNA)序列为检测目的,对人宫颈脱落上皮细胞进行体外定性检测的试剂,以确定受试样本中是否存在高于阳性判断值水平的高危型HPV病毒,或同时鉴定感染HPV的基因型别。此类试剂在临床上用于:(1)筛查宫颈细胞学检查为ASC-US(意义未确定的非典型鳞状上皮细胞)结果的患者,以确定是否需要进行阴道镜检查(以下简称ASC-US人群分流用途);(2)对于30岁及以上的女性,通过检测是否有高危型HPV感染,与宫颈细胞学检查联合进行宫颈癌筛查,此检测结合细胞学病史和其他风险因素的评估、以及临床诊疗和筛查指南的要求,用于指导患者的管理(以下简称宫颈癌联合筛查用途);(3)对于某年龄段(根据临床试验结果而定)女性,通过检测是否有高危型HPV感染,进行宫颈癌筛查,此检测结合细胞学病史和其他风险因素的评估、以及临床诊疗和筛查指南的要求,用于指导患者的管理(以下简称宫颈癌初筛用途)。除此以外,若申请人提出其他的预期用途,则应详细描述相关的临床背景信息和该检测与临床用途的相关性,并在临床试验中充分验证相关的临床意义。
该类试剂应通过临床试验路径进行临床评价,临床试验包括产品临床性能研究和针对预期用途的临床有效性研究两部分。临床试验应符合《体外诊断试剂注册与备案管理办法》《医疗器械临床试验质量管理规范》和《体外诊断试剂临床试验技术指导原则》的要求,如相关法规、文件有更新,临床试验应符合更新后的要求。下面仅说明该类产品临床试验中应关注的重点问题。
1. HPV核酸临床检测性能研究设计
1.1临床试验方法
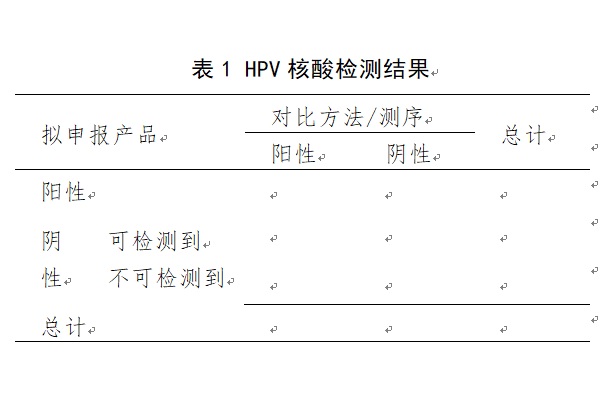
申请人应选择已批准上市、临床普遍认为质量较好的同类产品和/或核酸序列测定方法作为对比方法,采用拟申报产品与之进行比较研究试验,以评价拟申报产品检测目标HPV基因型的能力。需要注意的是,当拟申报产品的阳性判断值高于最低检测限水平时,检测结果判定为“阴性”的情况包括两种,其一为待测样本中存在高于最低检测限水平的HPV靶核酸,但靶核酸水平低于阳性判断值;其二为待测样本中无HPV靶核酸,或靶核酸水平低于最低检测限水平。在检测结果的统计分析中应分别列明各种情况,可参考表1。
1.2临床试验对比方法选择
临床试验应选择已上市的同类产品作为对比试剂,评价申报产品与已上市同类产品的一致性。对比试剂的选择应考虑检测的人乳头瘤病毒型别范围、产品性能等方面应与试验体外诊断试剂具有良好的可比性。针对不区分型别的检测试剂,应采用适当的方法确认纳入临床试验的阳性病例样本HPV型别;针对分型检测试剂,对比方法应能够充分评价每个型别的临床检测性能。选择已上市同类产品进行临床试验时,对比试剂配套使用的核酸提取试剂应满足其说明书要求。
申请人亦可采用试验体外诊断试剂与核酸序列测定(Sanger测序)方法进行对比试验,评价两种检测方法的一致性。同时还应进行部分病例与已上市同类产品进行对比试验。以上两方面评价结果结合起来共同论证试验体外诊断试剂的临床性能。
临床试验资料中应对测序方法进行详细的介绍,应采用公认的靶基因进行测序,针对靶基因的选择应提供依据。明确检测过程中配套使用的核酸提取试剂,针对测序方法提交性能验证数据,证明测序方法与试验体外诊断试剂的可比性。如测序试验委托其他机构完成,还应提交由临床试验机构委托第三方机构/实验室开展相关试验的测序服务合同/协议,提交相关机构资质和选择依据。
有关核酸序列测定方法的资料要求:临床试验中如涉及核酸序列测定方法,则建议对扩增子进行双向测序。应在临床研究报告中对选用的测序方法做详细介绍,并提供以下关于测序试验的详细信息及资料。
1)测序方法原理、测序仪型号、测序试剂及消耗品的相关信息。
2)测序方法所用引物相关信息,如基因区段选择,分子量、纯度、功能性试验等资料。
3)对所选测序方法的分析性能进行合理验证,尤其是最低检测限的确认,建议将所选测序方法与拟申报产品的相关性能进行适当比对分析。
4)测序方法应建立合理的阳性质控品和阴性质控品对临床样本的检测结果进行质量控制。
5)提交有代表性的样本测序图谱及结果分析资料。
1.3临床试验受试人群的选择及样本采集
病例选择及样本类型:受试者应包含各种临床表现的人群,如:宫颈细胞学检查正常者、宫颈上皮细胞异常者以及诊断为宫颈上皮内瘤变(CIN)和宫颈浸润癌等的患者,受试者年龄应在<30、30~39、40岁以上年龄段均有分布。
临床试验如选择与已上市同类产品进行比对的设计,且试验体外诊断试剂与对比试剂由于样本采集、处理、保存等差异不能使用同一份样本进行检测,此时可针对每位受试者进行两次样本采集,并分别进行试验体外诊断试剂和对比试剂的检测,两次采集样本的顺序应遵循随机原则。需要注意的是,临床试验应保证一次样本采集不会影响下一次样本采集。
1.4临床试验样本量
建议以与对比方法的比较研究为基础进行样本量估算。临床试验阳性样本和阴性样本数量应分别满足统计学要求。针对与Sanger测序法或同类已上市产品的对比试验,可采用目标值法公式分别估算整体最低阳性和阴性样本例数。
样本量估算公式如下:

其中阳性符合率和阴性符合率的临床可接受标准(P0)建议不低于90%。临床试验结果中,相关评价指标的95%置信区间下限应不低于预设的临床可接受标准。当评价指标P接近100%时,上述样本量估算方法可能不适用,应考虑选择更加适宜的方法进行样本量估算和统计学分析,如精确概率法等。申请人亦可以选择其他样本量估算模型,但应详述该样本估算模型及相关参数设置的的科学性、合理性。
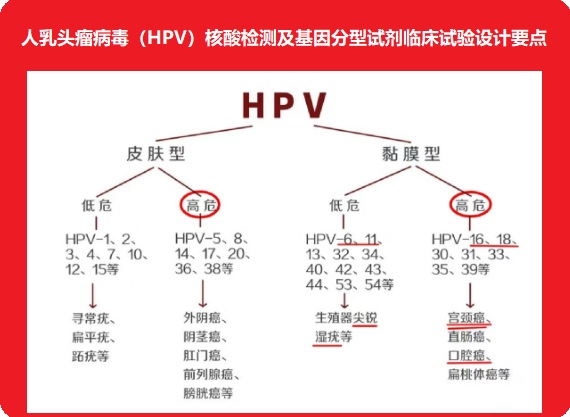
临床试验中,针对产品检测范围内的每种HPV基因型均应具有一定的阳性例数。结合产品临床性能评价需要及HPV感染阳性率,建议16型阳性不低于100例,18型阳性不低于50例,其他各型别,如能够分型,建议各型别分别不低于30例;如不能分型,产品能够涵盖的各亚型建议分别不低于20例。针对临床试验过程中确实难以收集的亚型,在提供相关证据的前提下,病例数可酌情减少。
鉴于此类产品样本采集过程对检测结果的准确性至关重要,因此,如产品可采用不止一种样本保存液,则应针对不同的样本保存液进行同源样本的比较研究试验,证明不同的样本保存液不会影响检测结果。相关比较研究试验应于2家以上(含两家)临床试验机构进行,样本例数不少于100例。
1.5统计学分析
应选择合适的统计学方法对比较研究试验的检测数据进行合理分析。对于此类试剂的比较研究试验,常选择交叉四格表的形式总结两种方法定性检测结果,计算阳性符合率、阴性符合率和总符合率,并计算95%置信区间,以考察两种方法检测结果的一致性。
对于基因分型试剂,临床试验中应分别验证该产品对可鉴别HPV基因型的临床检测准确性,针对不同基因型HPV分别完成如上所述的统计学分析。
结果差异样本的分析和验证:对于两种方法的检测结果不一致的样本,申请人应针对具体情况进行合理分析,必要时选择其他合理的方法进行验证,亦可结合患者的临床病情进行分析。
2.预期用途的临床有效性研究设计
2.1针对ASC-US人群分流用途
2.1.1临床试验方法
申请人应在适合进行宫颈细胞学检查的女性中,入组宫颈细胞学检查为ASC-US的受试者,针对入组的ASC-US人群首先采用拟申报产品进行HPV核酸检测,然后,无论HPV检测结果如何,均应进行阴道镜检查,根据阴道镜检查结果,必要时取样进行组织病理学检查。建议采用同一份宫颈上皮细胞样本进行细胞学检查和HPV检测,以避免样本取材不同带来的偏差;而宫颈细胞样本采集与阴道镜检查之间的时间间隔不应过长,建议不超过12周。以阴道镜检查和组织病理学检查结果为金标准,评价拟申报产品的临床性能。
2.1.2临床试验受试人群
临床试验入组人群应为宫颈细胞学检查为ASC-US的受试者,临床试验建议前瞻性入组,应避免选取已确定需进行阴道镜检查的人群,以免造成入组人群的倾向性,临床试验应以来自筛查的人群为主。入组人群应尽量在不同的年龄范围均有分布(<30、30~39和40岁以上),各年龄组受试者例数及CIN2以上病例均应有一定的病例数。
2.1.3临床试验病例数
应根据检测试剂灵敏度要求、疾病发病率等对入组样本例数进行科学的分析和计算,本临床研究建议以临床灵敏度为主要评价指标,采用抽样精度的模型进行样本量估算。临床试验终点为病理学检查结果≥CIN2。可采用如下公式:
2.1.4 统计分析
临床试验结果一般以四格表的形式进行总结,并据此计算临床灵敏度、临床特异性、阳性预期值、阴性预期值、阳性似然比、阴性似然比,并采用适当的方法计算95%置信区间;对于基因分型试剂,还需针对可鉴别的基因型单独完成上述数据统计分析,应能够支持基因分型的临床意义;数据统计和分析方法参见表2和表3。
临床试验结果:应通过分析灵敏度、特异度、阳性似然比和阴性似然比的结果判断拟申报产品用于ASC-US人群分流的临床性能是否能够满足临床要求。
如有人乳头瘤病毒(HPV)核酸检测及基因分型试剂临床试验设计及数据统计服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。