对于看美国市场的医疗器械企业来说,上市成本除了固定金额的企业注册、产品列名、510K评审费之外,更大一笔支出是为了满足美国FDA对医疗器械注册产品检测的要求,一起来看一下有哪些检测要求。
引言:对于看美国市场的医疗器械企业来说,上市成本除了固定金额的企业注册、产品列名、510K评审费之外,更大一笔支出是为了满足美国FDA对医疗器械注册产品检测的要求,一起来看一下有哪些检测要求。

众所周知,FDA的510(K) 的原则是证明申报器械和已经在美国合法上市的器械是实质等同。如果能够证明是实质等同,那么就可以确认其满足FDA 510(K)的要求。
实质等同包括了很多方面的内容,包括产品的预期用途,工作原理,结构和配件,很重要的一点是包括其安全性和功能性。下面我们通过两个产品来分析,一个是无源器械活检针,一个是有源器械电动轮椅。
1.电动轮椅:
进行实质等同比对的项目包括:主体框架材料和设计,折叠机制,座椅设计,座椅附件,轮椅总体尺寸,座椅尺寸,折叠后尺寸,轮椅重量,电池重量,控制器,驱动模式,电机类别,电机功率,电池类型,电池数量,电池规格,充电模式,刹车类型,刹车距离,各部件材料。除了这些之外,还需要比对生物相容性、EMC、性能要求。分别涉及到如下的检测标准,需要提供全套测试报告:

2.活检针:
进行实质等同比对的项目包括:预期用途、尺寸规格、作用机理、可用性、动力类型。还包括系列测试:
(1)生物相容性和灭菌:
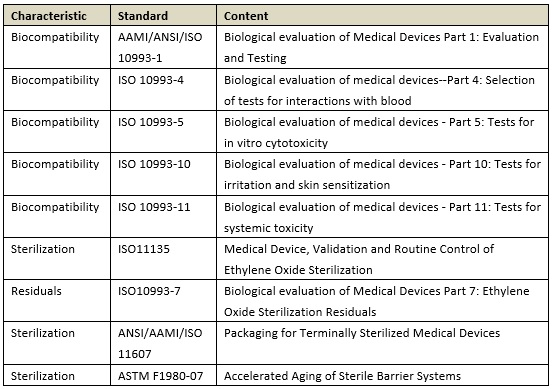
(2)性能测试和比对测试:
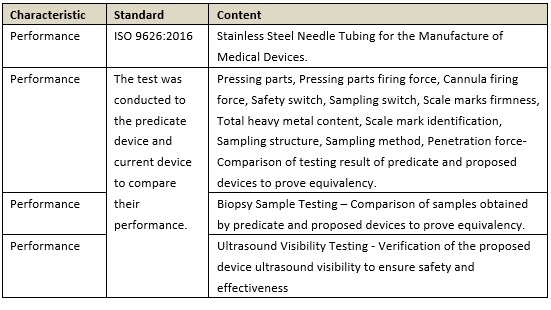
从上述两个案例来看,要证明产品实质等同就必须要提供详实的实验数据予以支撑,才能得到有效的结论。
标签:美国FDA医疗器械注册