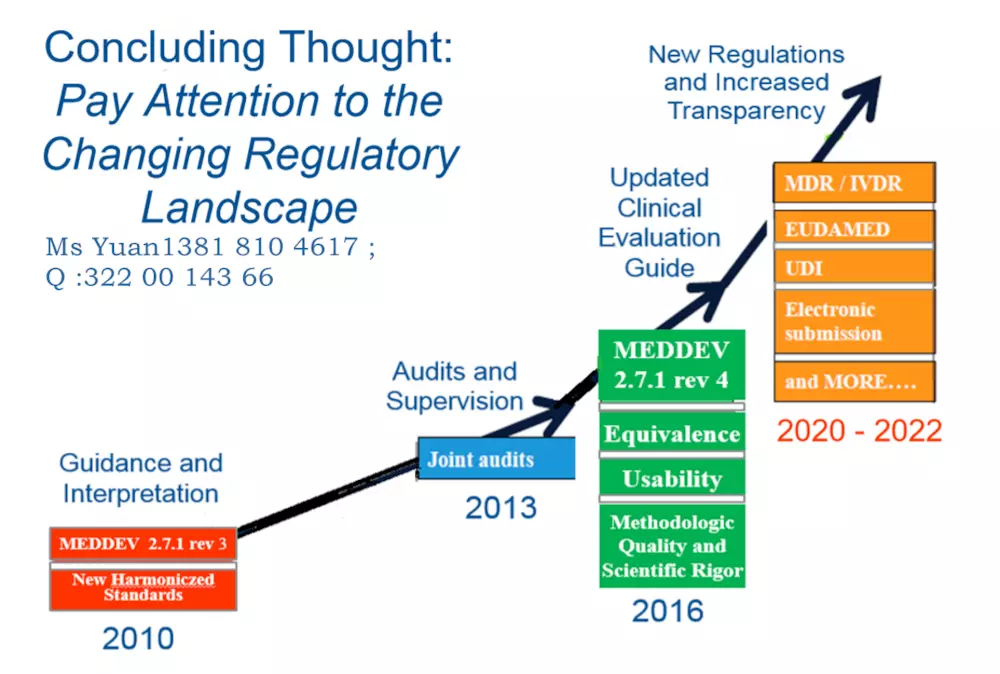
2017年5月,欧盟医疗器械新法规MDR (REGULATION EU 2017/745) 颁布,新的法规将替代原有的医疗器械指令 (MDD 93/42/EEC) 和有源植入性医疗器械指令 (AIMDD 90/385/EEC) 。
2017年5月,欧盟医疗器械新法规MDR (REGULATION EU 2017/745) 颁布,新的法规将替代原有的医疗器械指令 (MDD 93/42/EEC) 和有源植入性医疗器械指令 (AIMDD 90/385/EEC) 。
从2020年5月开始公告机构不能按照MDD颁发CE证书,目前 I*及以上风险等级产品认证机构已不再受理MDD指令的认证申请。
对于目前获得医疗器械CE认证证书的企业,应基于自身设备的临床证据的充分性合理安排申请MDR的时间,尽快启动MDR法规合规准备事宜。
欧盟委员会规定了MDR 的转换期的要求
2017年5 月25 日:MDR 和IVDR 生效
2020年3 月25 日:启动欧盟医疗器械数据库(Eudamed)
2020年5 月25 日:MDR 实施开始
2022年5 月25 日:IVDR 实施开始
2024年5 月25 日:AIMD,MDD 和IVDD 证书将失效
我们该怎么办?
l 重新确认产品风险分类等级,确认是否有风险等级升级的情况?
例如部分可重复使用的医疗器械,原属于ClassⅠ的器械,按照新法规变成了ClassⅠ*类器械。美容类产品原MDD下不属于医疗范围,现MDR法规中已纳入;
l 确认原CE证书的发证机构是否已获得欧盟当局批准的颁发MDR证书的资质,目前拥有该资质的认证机构:BSI、TUV南德(注意TUV莱茵目前还未获得批准);
l 确认原CE认证时的技术文件中是否含有按照Rev4指导原则提供的临床评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、资质和经验来承担相应的法规工作职责。
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证资质的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证书。