CE认证是欧盟的产品安全认证,所有进入欧盟市场的医疗器械都必须进行医疗器械CE认证,医疗器械需要满足的CE指令有《有源植入性医疗器械指令》(AIMDD, 90/385/EEC)、《医疗器械指令》(MDD,93/42/EEC)和《体外诊断器械指令》(IVDD, 98/79/EC)。
CE认证是欧盟的产品安全认证,所有进入欧盟市场的医疗器械都必须进行医疗器械CE认证,医疗器械需要满足的CE指令有《有源植入性医疗器械指令》(AIMDD, 90/385/EEC)、《医疗器械指令》(MDD,93/42/EEC)和《体外诊断器械指令》(IVDD, 98/79/EC)。
一、CE认证简介

CE标记是法律标记,可以按一定比例放大和缩小。也可以看成是两个相交的圆,两个字母是等高的,字母“E”中间的一划要比上下两笔略短少许。CE标记高度不能低于5mm。
二、医疗器械指令简介
适用于心脏起搏器、可植入的胰岛素泵等,已于1993年1月1日生效,1995年1月1日强制实施。
已于1995年1月1日生效,1998年6月14日强制实施,目前已升版为2007/47/EC。
适用于血细胞计数器、妊娠检测装置等,已于1998年12月7日生效,2003年12月7日强制实施。
三、93/42/EEC中的定义、范围
——疾病的诊断、预防、监视、治疗或减轻
——损伤或残障的诊断、监视、治疗、减轻或修补
——解剖学和生理过程的探查、替换或变更
——妊娠的控制
医疗器械不是通过药理学、免疫学或代谢学作用等方式在人体内或人体上达到其预定的主要作用,但这些方式有助于其他功能的实现。
附件:本身虽然不是器械,但由其制造商专门指定与器械一起使用,使其能够按照制造商预定的器械用途来使用
制造商:是指在以其名义将器械投放市场前负责器械的设计、制造、包装和标签的自然人或法人,无论这些工作是自己完成的,还是由第三方代表他完成的。
预期用途:是指根据制造商在标签、说明书和或宣传材料中提供的资料对器械预期的用途。
四、基本框架
MDD93/42/EEC指令共有23条款和12附录。其重点包括:
条款 1.本指令适用于医疗器械及其附件。
条款 2.成员国必须保证医疗器械只有在保证人身安全和健康时才能被投放市场和投入使用。
条款 3.能保证安全和健康的器械是指满足附录I中基本要求的器械。
条款 4.带有CE标识的医疗器械可以在欧盟市场自由流通。特殊用途的器械不应加贴CE标志:做临床试验的器械和定制器械。
条款 5.符合协调标准的医疗器械被认为满足基本要求。
条款 8.如果发现器械不安全的话,保护条款允许某个成员国采取行动,召回已上市产品,或禁止、限制其投放市场。
条款 9.依据附录IX进行分类,分为I、IIa、IIb、III类。
条款 10.上市后事故报告的要求,执业医师和医疗机构,制造商和欧盟代表都应向主管当局报告。
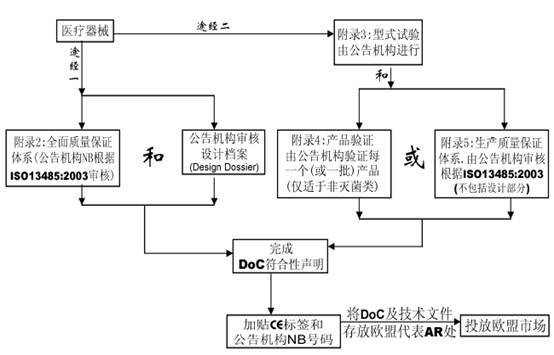
条款 11.医疗器械必须经过某一程序(附录II—VII)以证明其满足基本要求。
条款 12.有关系统和打包的医疗器械上市的特殊程序
条款 14.负责将器械投放市场的人员注册,欧盟数据库
条款 15.临床试验:参照附录X
条款 17.符合基本要求并通过了相应的符合性评价程序的医疗器械必须带有CE标志,参照附录XII
五、附 录
附录1.基本要求
附录2.全面质量保证体系
附录3.产品型式检验
附录4.产品验证
附录5.生产质量保证体系
附录6.产品质量保证体系
附录7.自我符合性声明
附录8.特殊用途的器械声明
附录9.分类规则
附录10.临床试验
附录11.选择公告机构准则
附录12.合格的CE标志
六、产品分类
分类规则的应用由器械的预期用途决定
如果器械是和其他器械配合使用, 分类规则分别适用于每种器械附件
可以和其他一起使用的器械分开独自分类
启动或影响某种器械的软件与器械本身属于同一类型,独立的软件属于有源医疗器械
如果几条规则适用于同一器械,以及这些规则的应用会导致不同的分类标准,则规则适用于导致最高分类级别
特别规则(规则13-18)优先于其他规则
时间:暂时(<60分钟)
短期(<30天)
长期(>30天)
创伤性:非创伤 通过人体孔径插入
外科创伤 植入
适用位置: 中央循环系统
中枢神经系统
人体孔径
其他地方
能量供应:无源 有源
规则1---8. 无源医疗器械的分类
规则9---12. 有源医疗器械的分类
规则13---18.特殊医疗器械的分类
规则1~4. 所有非创伤性器械均属I类,除非它们:
用于存储体液(血袋例外) | IIa类 |
与IIa或更高类型的有源医疗器械连接使用 | IIa类 |
改变体液成分 | IIa/IIb类 |
一些伤口敷料 | IIa/IIb类 |
规则5. 侵入人体孔径的医疗器械(不与有源医疗器械相连或仅与I类有源器械相连接)
暂时使用(例如:牙科诊断和治疗时使用的手持镜、牙科加压材料、胃减压管、灌肠器械、检查手套) | I类 |
短期使用(例如:气管导管、矫正隐形眼镜、导尿管) | IIa类 |
长期使用(例如:矫正隐形眼镜、导尿管) | IIb类 |
规则6. 外科创伤性器械暂时使用(如缝合针),属IIa类,以下情况除外:
可重复使用的外科器械(例如:钳子、斧子) | I类 |
与中央循环系统或中枢神经系统接触的器械 | III类 |
可以被吸收的 | IIb类 |
与有源器械连接向人体发送能量或药物 | IIb类 |
规则7.外科创伤性器械短期使用,属IIa类,以下情况除外
与中央循环系统或中枢神经系统接触的器械 | III类 |
产生生物学影响或可以被吸收的 | III类 |
与有源器械连接向人体发送能力或药物 | IIb类 |
规则8.外科创伤性器械长期使用(接骨板、眼内晶体) IIb类,以下情况除外
安装在牙齿上的器械 | IIa类 |
与中央循环系统或中枢神经系统接触的器械 | III类 |
可以被吸收的 | III类 |
向人体给药物装置 | III类 |
2003/12/EC乳房植入 | III类 |
2005/50/EC髋关节,膝关节,肩关节 | III类 |
规则9.用于施药或换能的有源治疗器械
给予或交换能量的有源治疗器械,(例如:肌肉刺激器、电钻、皮肤光疗机、助听器、理疗超声设备) | IIa类 |
以一种潜在的危险方式工作的(例如:婴儿保温箱、高频电刀、超声碎石器、外科激光器、X光机) | IIb类 |
规则10.诊断用的有源器械
提供能量(例如:核磁共振、超声诊断仪) | IIa类 |
诊断/监视体内放射药物分布(例如:r照相机、正电子发射成像仪) | IIa类 |
诊断/监视生理功能(例如:心电图、脑电图) | IIa类 |
危险情况下监视生理功能(例如:手术中的血气分析仪) | IIb类 |
发出发射电离辐射(例如:X射线诊断仪) | IIb类 |
规则11.控制药物或其物质进出人体的有源器械属于IIa类
如以一种潜在的危险方式工作(例如:麻醉机、透析机、高压氧舱) | IIb类 |
规则12.所有其他有源医疗器械属于I类
(例如:观察灯、牙科椅、轮椅、牙科用治疗灯、记录处理观察诊断图像用的有源器械)
规则13.与药品或血液制品结合的器械
(例如:含杀精子的避孕套、含抗生素的牙髓材料)属于III类
规则14.避孕用具
规则15.清洗或消毒的器械
医疗器械 | IIa类 |
侵入或创伤医疗器械(例如:内窥镜消毒) | IIb类 |
接触镜(例如:消毒液、护理液) | IIb类 |
规则16. 用于记录X射线图像的器械(例如:X光片、荧光盘)属于IIa类
规则17. 利用动物组织或衍生物的器械(例如:生物心脏瓣膜、肠线、胶原)属于III类
规则18. 血袋属于IIb类
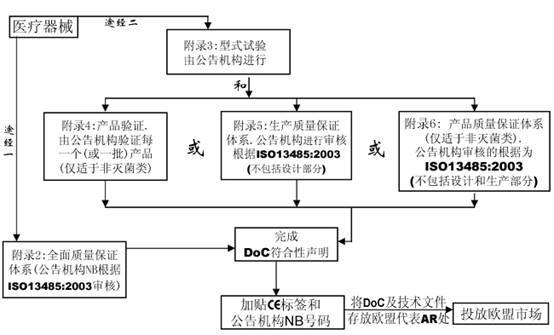
七、合格评定程序
在MDD指令中共有7个合格评定程序,用于该指令条款11中规定的各类器械的合格评定。
附录2 EC符合性声明—全面质量保证体系(常用的符合方式)
附录3 EC产品型式检验
附录4 EC产品验证
附录5 EC符合性声明—生产质量保证体系
附录6 EC符合性声明—产品质量保证体系
附录7 EC符合性声明—自我符合性声明
? 附录8 特殊用途的器械声明
附录2 EC符合性声明—全面质量保证体系(常用的符合方式)
该全面质量保证体系包括产品的设计和生产。它可用于除I类产品外的所有其他产品的合格评定。对于III类产品,设计文档检查和该附录条款4中的认证是必须的,对于IIa类产品,无需设计文档检查。
附录3 EC产品型式检验
该附录描述了产品型式试验的程序,即制造商向公告机构递交完整的产品技术文档以及产品的代表性样品。公告机构检查产品是否与技术文档一致,并是否符合基本要求,如需要则进行这方面的测试,EC型式检验证书。该附录仅包括器械的设计,并适用于IIb或III类医疗器械。
附录4 EC产品验证
该EC产品验证程序确保器械依据一个认可的型号或技术文件中描述的器械生产。在该程序下,公告机构检查每个或多个样品并进行试验以证明产品是否符合已认可文件化的设计。该程序不适用于无菌医疗器械。
附录5 EC合格声明—生产质量保证体系
该附录描述了一个生产质量保证体系,即由公告机构证明该体系能保证器械能够依据认可的型号,或依据技术文件中描述的器械生产。该附录适用于IIa, IIb和III类器械。
附录6 EC合格声明—产品质量保证体系
该附录描述了一个质量体系,该体系通过产品的最终检验和试验以确保生产的器械符合已认可的型号,或技术文件中规定的器械。该附录适用于IIa和IIb类器械。该程序不适用于无菌类医疗器械。
附录7 EC合格声明—自我符合性声明
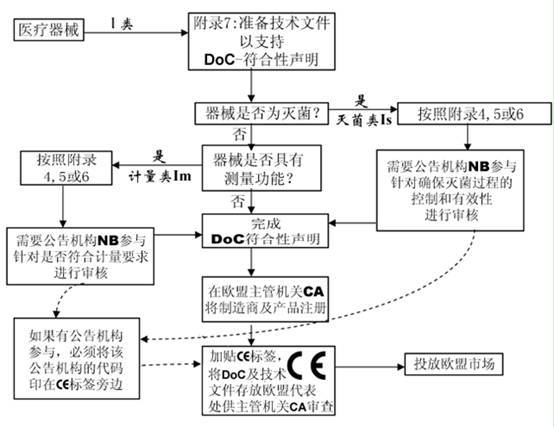
该附录描述制造商必须准备技术文件以支持某类医疗器械的合格声明,这里无需公告机构介入。该附录适用于I和IIa类器械。
附录8 特殊用途的器械声明
该附录描述对于定制器械和临床调查类器械,制造商必须准备技术文件以支持医疗器械的合格声明,这里无需公告机构介入。
八、CE认证的基本流程
1.分析该器械的特点,确定它是否在指令范围内
2.确定该器械的分类类别
3.确认适用的基本要求/有关的协调标准
4.确认该器械满足基本要求/协调标准,并使证据文件化(技术文档的整理)
5.确定相应的符合性评价程序
6.对于IIa类或更高类型器械,以及I类无菌或测量器械,应通过公告机构并进行符合性评价程序
7.起草符合性声明并加贴CE标志
I 类
IIa 类
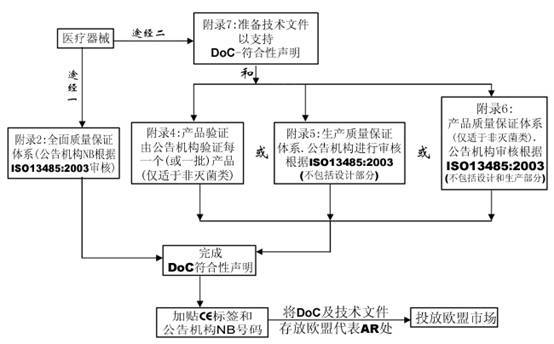
IIb 类
III 类