根据国家药品监督管理局2023年度医疗器械注册审查指导原则制修订计划的有关要求,2023年11月11日,国家药监局发布《弹簧圈系统同品种临床评价注册审查指导原则(征求意见稿)》,一起看正文。
根据国家药品监督管理局2023年度医疗器械注册审查指导原则制修订计划的有关要求,2023年11月11日,国家药监局发布《弹簧圈系统同品种临床评价注册审查指导原则(征求意见稿)》,一起看正文。
弹簧圈系统同品种临床评价注册审查指导原则(征求意见稿)
本指导原则旨在指导医疗器械注册申请人对弹簧圈系统开展临床评价,同时也为技术审评部门审评弹簧圈系统临床评价资料提供参考。
本指导原则是对弹簧圈系统临床评价的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
一、适用范围
本审评要点适用于常规设计的弹簧圈系统,通常由弹簧圈和输送系统组成,临床用于颅内和外周血管的动脉瘤、动静脉畸形和动静脉瘘的填塞。
弹簧圈线圈通常由铂钨合金或铂铱合金制成;推送杆芯通常由不锈钢制成;该产品分类编码为13-06-08,管理类别为Ⅲ类。
与境内已上市产品相比,若产品具有全新的设计和适用范围时,现有的临床数据和非临床研究不能证明申报产品安全有效的,可考虑通过临床试验来获得临床数据。
二、同品种临床评价的基本要求
(一)同品种医疗器械的选择
注册申请人通过同品种比对方式开展弹簧圈系统的临床评价时,可选用一个或多个同品种医疗器械进行比对,宜优先选择与申报产品适用范围相同、技术特征(如材料、设计等)相同或尽可能相似的产品作为同品种医疗器械。需要选择多个同品种产品时,应充分说明理由,与每一个同品种产品进行对比时建议考虑对比全部项目。
(二)适用范围及临床使用相关信息的对比
对比申报产品和对比器械在适用范围以及临床使用相关信息的相同性和差异性,建议重点考虑以下内容对比(包括但不限于):
1.适用人群,如年龄等。
2. 适用部位/适应证:
不同类型的弹簧圈可能会有不同的预期用途,如颅内和外周血管的动脉瘤、动静脉畸形和动静脉瘘等。在选择同品种产品时,不同适用部位(颅内和外周血管)应分别选择进行比对。
3. 适用的疾病阶段和程度,如动脉瘤出血急性期等。
4. 使用方法,如手术入路、解脱方式、需符合诊疗指南的相关要求等。
5. 禁忌证、警告及预防措施。
6. 其他,如特殊设计或涂层功能的宣称,如膨胀芯丝的功能等。
(三)技术特征的对比
申报产品与同品种医疗器械技术特征对比着重关注以下对比内容,包括但不限于:
1. 结构组成
弹簧圈系统的可植入部分一般包括:弹簧圈丝体、抗解旋结构、亲水性芯体(如有)、微纤毛(如有)等。
输送系统部分一般包括:枢纽接头、导入套管、推送杆(显影标记)、与弹簧圈的连接部位(解脱区域)、辅助部件(如有)等。
2. 产品设计和关键尺寸
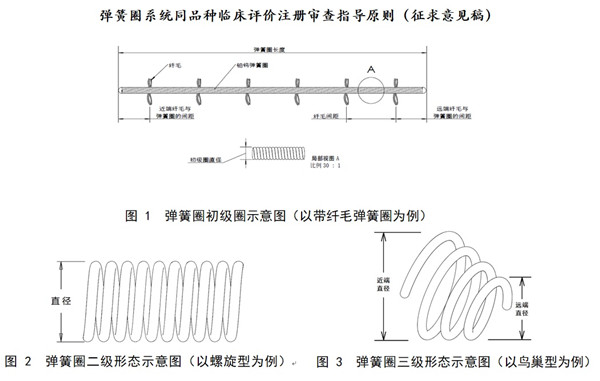
2.1尺寸:弹簧圈长度,初级圈直径,弹簧圈第一圈直径/弹簧圈直径,推送杆长度、直径;
2.2形态:初级圈、二级圈形态和弹簧圈尖端构形。其中次级结构二维形态包括球形、复合形、螺旋形、钻石形等;三维形态,包括立体型、鸟巢型等(见图1、图2、图3)。
2.3特殊设计:如含水凝胶膨胀芯丝弹簧圈可考虑比较溶胀性能,微纤毛弹簧圈可考虑比较纤维毛长度、分布情况、附着机制和纤维毛连接牢固度,亲水涂层可考虑比较涂层完整性等。
2.4解脱方式及机理:如电解脱、机械解脱、热熔解脱、水解脱等。应提供弹簧圈及解脱区域的装配连接方式及解脱机理的可靠性研究。
3. 产品性能要求
根据产品的设计特征选取典型性型号对比性能要求。多数情况下,有行业公认的接受标准时,如有已发布的国家或行业标准时。该性能可不进行对比,提供产品自身符合要求的验证资料。如物理性能中的弹簧圈二级形状保持试验、弹簧圈和推送杆耐腐蚀性、推送杆抗破裂性、推送杆抗弯曲性、弹簧圈系统及各组件的可追踪性能和重复定位性能、微粒控制、成篮性能(若适用)、溶胀性能(若适用)等。
其他性能指标建议与同品种器械在相同试验条件下对比实测值,测试结果应非劣于同品种器械。带或不带纤毛弹簧圈、不同二/三维形态弹簧圈需分别进行对比。申请人需选取合理的规格型号作为典型性产品。常见的指标一般包括:
3.1弹簧圈抗解旋强度;
可使用拉力机测定拉伸弹簧圈直至使其开始出现解旋状态或抗解旋丝断裂的过程中的最大力。
3.2 弹簧圈系统解脱性能(解脱时间);
测定使弹簧圈从推送杆上顺利解脱所需要的时间。
3.3 弹簧圈系统解脱区连接强度(抗拉强度);
可使用拉力机测定拉伸弹簧圈和推送杆,使两者发生分离的过程中的最大力。
3.4弹簧圈系统模拟使用性能(推送性能、回撤性能和反复释放疲劳);
推送力:评价将弹簧圈系统沿微导管推送的能力。可采用定性评价的方式,也可采用对推送过程中的力(推送力)进行定量评价的方式。
回撤性能:评价将弹簧圈系统从微导管中撤出的能力。
反复释放疲劳:评价将弹簧圈推出微导管然后撤回并反复进行以上操作的情况下,弹簧圈保持完整性的能力。
(四)论证差异不对安全有效性产生不利影响
使用同品种对比路径进行临床评价,若同品种产品是申报产品的前代产品(同一注册申请人),申报产品是前代产品的改进,其结构组成、材料、设计、性能指标等方面基本保持一致,通过台架试验可证明其安全有效性的,可仅提交台架试验资料。例如模拟血管内的输送和回撤性能试验、弹簧圈解脱性能试验等。
若与非前代产品进行比对,或与前代产品的差异不能用台架试验解决时,需开展动物试验。动物试验可以模拟临床较严苛情况,通过病理学检查等手段观察可能的损伤和不良事件,评价临床较极端情况下产品的安全有效性。因此具有良好质量的动物试验数据可能成为申报产品的主要支持性证据。动物试验推荐设立对照组,建议选用同品种产品作为对照产品,以判定动物试验结果的可接受性。申请人需充分论述动物试验样本量的选择理由。
申请人需阐述动物试验中选取的产品规格型号的代表性,一般情况下带或不带纤毛弹簧圈、与同品种对比相同的二/三维形态弹簧圈、全新的二/三维形态弹簧圈应分别选取代表性型号。代表性型号产品应按临床使用的实际情形进行验证,若申请人宣称不同型号产品间有配合使用的情况,需在动物试验中验证。
1.动物模型的选择和建立
申请人应考虑选取动物种类和数量的代表性和合理性,一般可选择大动物如猪、犬作为试验动物。动物模型的选择应与申报的适用范围相适应,其中,颅内动脉瘤模型试验可覆盖颅内和外周的动脉瘤、血管畸形和动静脉瘘的适用范围。建议建立动脉瘤病理模型,申请人需明确模型建立后的信息,包括瘤体的尺寸、体积、形态(瘤体长度、瘤颈宽度和瘤颈比)、载瘤动脉直径大小等信息。如适用于血管填塞,建议选择合适的靶血管,明确靶血管的尺寸、形态等信息。外周血管填塞试验可覆盖外周动静脉填塞和动静脉瘘的适用范围。动物试验设计应能证明申报产品体内应用的安全有效性,若申请人宣称申报产品需配合其他器械使用,应按临床实际使用情况开展验证,申请人需论述动物模型的适用性。
目前国内外也有选择兔作为动物模型开展动物试验的情形,一般情况下兔模型中兔颈总动脉的血管直径和迂曲度可一定程度上模拟人体血管情况,但由于兔体型较小,在血流动力学如血液流量、血压等方面难以模拟人体情况,因此申请人应谨慎使用兔模型,兔模型一般用于基于前代产品的变更产品,申请人需基于产品变更的情况和兔模型的适用性、局限性,充分论述选用兔模型的合理性。
2.血管的选择
动物试验中选择的靶血管应尽可能模拟临床人体颅内血管或外周血管的特征,申请人应确保选择的血管应能覆盖拟申报的适用范围,需从血管直径、血管迂曲度、血管壁特征和血流动力学等方面论述所选择血管的代表性。以猪模型为例,若申报颅内血管的适应证,所选择的血管应为受试动物颅内供血的血管,可以考虑选择颈动脉,若申报外周血管的适应证肱动脉、肾动脉以及其他适宜的血管。申请人应逐一说明靶血管的选择理由和依据。每个动物可选择多个血管进行试验,动物试验中可以选用不同解剖学部位的血管共同验证产品安全有效性。
3.评价指标
作为主要的支持性资料之一,动物试验的评价指标应尽可能客观、全面。试验过程中,应分别评价动脉瘤和血管在使用申报产品封堵和填塞的安全性和/或有效性。根据各指标的观察时间点,颅内弹簧圈的动物试验随访时间通常不少于180天,外周弹簧圈随访时间通常不少于90天。随访时间一般包括术中、术后即刻、30天、90天(外周)或180天(颅内)。建议申请人在所有随访时间点观察安全性指标,在术后即刻、30天及最终随访时间点观察影像学指标,在最终随访时间点观察病理组织学和病理学相关指标。评价内容一般包括:
3.1安全性评价
3.1.1急性并发症(e.g.瘤体破裂,植入段血管损伤、阻塞、意外血栓形成,周围组织血肿);
3.1.2评价手术过程和随访期间动物健康情况;
3.2有效性评价
3.2.1术后即刻血流动力学变化(造影观察靶血管血流情况);
3.2.2随访期内动脉瘤封堵/血管填塞情况(e.g.栓塞状态如Raymond评分、瘤体体积栓塞率(植入弹簧圈体积/瘤体体积)、血管再通等);
3.2.3病理组织学检查(e.g.术后短期:机化血栓和动脉瘤内纤维化情况,血管内皮细胞覆盖、动脉瘤内结缔组织沉积情况;术后长期:载瘤动脉管腔通畅、无组织侵犯管腔生长等)和血液生化检查(血常规等)
3.3可操作性评价
包括系统的输送和回撤性能、解脱性能(解脱时间、分离性)、系统的可视性等;
3.4病理学检查
一般包括重要器官和组织,如血管、心脏、脑、双侧肾脏、脾脏、肝脏、肺、舌、淋巴等。
三、同品种医疗器械的临床数据
弹簧圈系统产品风险较高,建议优先选择已上市的前代产品或具有长期临床安全应用史的产品作为同品种医疗器械。该类产品积累了一定的临床数据,含有较多公开的临床数据,如临床文献,其在真实的临床实践环境中的安全有效性较为确切。
弹簧圈系统同品种医疗器械的临床数据常包括临床试验数据、临床经验数据、临床文献数据类型。
(一)有效性数据
对于弹簧圈系统,有效性临床数据可参考以下关键要素提取数据:
1.患者信息:性别、年龄、疾病类型、使用器械、随访时间及其他影响临床结局的特征等;
2.产品信息:产品名称;型号(若有)等;
3.研究设计:设计类型、样本量、OCEBM等级;
4.评价指标:完全闭塞/Raymond Roy闭塞分类、血管再通、再次治疗、改良Rankin量表(mRS)、视觉模拟量表(VAS)、Barthel指数、格拉斯哥昏迷评分量表、Hunt和Hess分级、NIHSS。
如上所述,弹簧圈系统产品有效性评价指标种类较多,在收集和分析同品种医疗器械有效性数据时,应分别对适宜的评价指标数据进行汇总分析。
(二)安全性数据
常见的弹簧圈系统安全性数据列举如下:
1.与器械相关:器械断裂/故障/失效、弹簧圈位移、分离失败、提前解脱、定位困难、进入载瘤血管、弹簧圈疝、弹簧圈球上血栓等;
2.与手术相关:血栓栓塞事件/出血、出血、动脉瘤破裂、血管夹层/穿孔/损伤、血管闭塞、梗塞/卒中/短暂性脑缺血发作、血管痉挛、神经功能损伤、感染、脑积水、疼痛、心肌梗死、死亡及其它;
不良事件信息:建议以表格的形式提供各国上市时间、不良事件类别及数量、与产品相关性、事件描述、原因分析、处理方式和处理结果等。
四、参考文献
[1]国家药品监督管理局.医疗器械临床评价技术指导原则:国家药监局通告2021年第73号[Z]
[2]《中国颅内未破裂动脉瘤诊疗指南》
[3]《中国颅内破裂动脉瘤诊疗指南》
[4]《血流导向装置治疗颅内动脉瘤中国指南》
[5]《血流导向装置治疗颅内动脉瘤的中国专家共识》
[6]《颅内动脉瘤血管内介入治疗中国专家共识》
[7]美国FDA血管和神经血管栓塞器械指南
[8]YYT 1748-2021,《神经血管植入物 颅内弹簧圈》[S]
[9]国家药品监督管理局. 医疗器械动物试验研究注册审查指导原则 第一部分:决策原则:国家药监局通告2021年第75号.[10]国家药品监督管理局. 医疗器械动物试验研究注册审查指导原则 第二部分:试验设计、实施质量保证:国家药监局通告2021年第75号.