甘肃下辖12个地级市、2个自治州,是西北地区经济和政治中心之一,也有非常好的医疗产业基础,正好因为工作出差到甘肃武威,写个文章为大家科普有关甘肃第二类医疗器械产品注册流程?和要求。
甘肃下辖12个地级市、2个自治州,是西北地区经济和政治中心之一,也有非常好的医疗产业基础,正好因为工作出差到甘肃武威,写个文章为大家科普有关甘肃第二类医疗器械产品注册流程和要求。
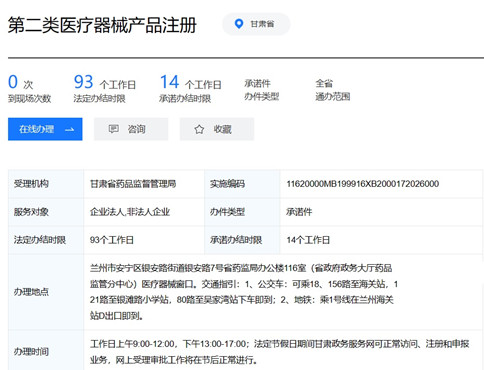
一、甘肃第二类医疗器械产品注册要多少时间?
1、受理之日起,3个工作日内将申报资料转交技术审评机构;60个工作日内完成第二类医疗器械注册的技术审评工作;技术审评结束后20个工作日内作出决定;10个工作日内发给医疗器械注册证。
2、技术审评过程中需要申请人补正资料的,申请人应当在1年内按照补正通知的要求一次提供补充资料;技术审评机构应当自收到补充资料之日起60个工作日内完成技术审评。申请人补充资料的时间不计算在审评时限内。
二、甘肃第二类医疗器械产品注册受理条件:
1、医疗器械注册应遵守相关法律、法规、规章、强制性标准,遵循医疗器械安全和性能基本原则,参照相关技术指导原则,证明注册、备案的医疗器械安全、有效、质量可控,保证全过程信息真实、准确、完整和可追溯。
2、申请人、备案人应当为能够承担相应法律责任的企业或者研制机构。
3、申请人、备案人应当建立与产品相适应的质量管理体系,并保持有效运行。
4、办理医疗器械注册、备案事项的人员应当具有相应的专业知识,熟悉医疗器械注册、备案管理的法律、法规、规章和注册管理相关规定。
5、申请注册,应按照国家药品监督管理局有关注册的要求提交相关资料,申请人、备案人对资料的真实性负责。
6、注册资料应当使用中文。根据外文资料翻译的,应当同时提供原文。引用未公开发表的文献资料时,应当提供资料权利人许可使用的文件。
7、医疗器械应当符合适用的强制性标准。产品结构特征、预期用途、使用方式等与强制性标准的适用范围不一致的,申请人、备案人应当提出不适用强制性标准的说明,并提供相关资料。
8、 医疗器械注册应遵循医疗器械分类规则和分类目录的有关要求。
三、甘肃第二类医疗器械产品注册流程:
第二类医疗器械产品注册流程图如下:
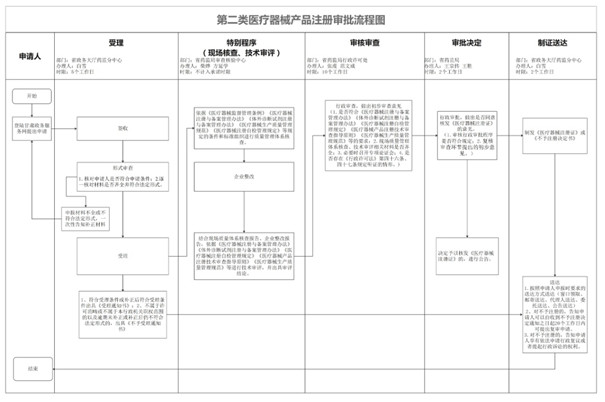
除流程图上所示事项之外,企业还需要预算准备第二类医疗器械注册申报材料的时间。