质子治疗作为新兴的一种放射治疗手段,已经越来越多的在国内外市场普及。在我国按照第三类医疗器械注册产品管理,产品上市前需要按要求完成医疗器械临床试验或同品种比对临床评价。一起来了解质子治疗系统临床评价国内外现状。
引言:质子治疗作为新兴的一种放射治疗手段,已经越来越多的在国内外市场普及。在我国按照第三类医疗器械注册产品管理,产品上市前需要按要求完成医疗器械临床试验或同品种比对临床评价。一起来了解质子治疗系统临床评价国内外现状。
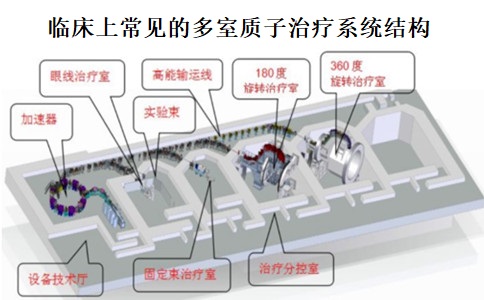
质子治疗作为新兴的一种放射治疗手段,已经越来越多的在国内外市场普及。目前,已有IBA、Varian等多个厂家的多款质子治疗系统产品在美国、欧盟和日本等市场上市,2022年9月,上海艾普强粒子设备有限公司生产的质子治疗系统是我国首台获批上市的国产质子治疗系统,意味着国产质子治疗设备实现“零的突破”。通过研究质子治疗系统在国内外的上市要求,我中心对质子治疗系统的临床评价要求形成了新的研究方向。
一、美国、欧盟等发达国家对于质子治疗系统上市前临床评价的情况
1.美国
质子治疗系统在美国的管理类别是II类,器械通过510(k)路径上市。510(k)路径要求申报器械与比对器械在预期用途和技术特征两方面进行对比以论证两者实质性等同,实质性等同包括两种情况:(1)申报器械与比对器械预期用途和技术特征完全相同;(2)申报器械与比对器械预期用途相同,技术特征存在差异,差异不引起不同的安全有效性问题,且提供的信息(如恰当的科学数据)证明申报器械具有与比对器械同样的安全有效性。
2.欧盟
质子治疗系统在欧盟的管理类别是IIb类。欧盟器械的临床评价贯穿于全生命周期,要求申请人基于器械预期用途,收集上市前临床数据,制定上市后监测计划,对器械临床安全性和有效性进行持续评价。欧盟MDR规定对于植入器械和III类器械除特殊情形下应开展临床试验,质子治疗系统不属于需开展临床试验的情形。
二、我国对于质子治疗系统开展上市前临床评价的情况
在我国,质子治疗系统划分为第三类医疗器械,国家药品监督管理局发布了《质子碳离子治疗系统临床评价技术审查指导原则》,为质子治疗系统在境内上市的临床评价要求提供了指导。随着质子治疗技术的进展,以及临床使用经验的不断积累,我国对于质子治疗系统的临床疗效的认识也在不断加深,对保障其安全有效的临床评价要求也需要与时俱进,以符合科学监管的需要。