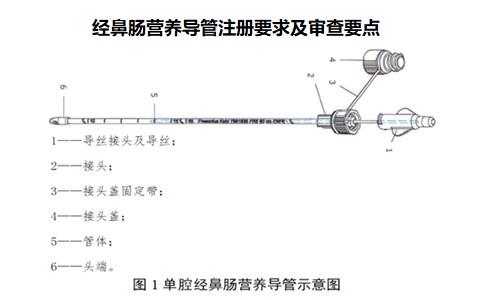
经鼻肠营养导管注册产品可采用TPU、聚氯乙烯、硅橡胶等材料制成,目前已上市产品常用材料为TPU。通常由头端、管体、接头、接头盖、导丝等组成。根据产品结构可分为单腔、双腔、三腔等,头端可有直插型、螺旋型、重力型、球囊等不同设计;接口有扣盖,有利于保持清洁;外壁带有数字刻度,可有效指示产品在体内的使用长度;管壁使用射线可探测材料,具有显影定位功能。
经鼻肠营养导管注册产品可采用TPU、聚氯乙烯、硅橡胶等材料制成,目前已上市产品常用材料为TPU。通常由头端、管体、接头、接头盖、导丝等组成。根据产品结构可分为单腔、双腔、三腔等,头端可有直插型、螺旋型、重力型、球囊等不同设计;接口有扣盖,有利于保持清洁;外壁带有数字刻度,可有效指示产品在体内的使用长度;管壁使用射线可探测材料,具有显影定位功能。
经鼻肠营养导管通常由鼻腔经食道插入胃,在胃肠蠕动的推动下滑移进入十二指肠或空肠内,或借助胃镜/十二指肠镜辅助插入十二指肠或空肠,并经X射线显影等方式确定置管位置,与相关给营养器械配合,用于向胃肠道引入营养液等,部分多腔鼻肠管还可用于胃部冲洗等。
1.经鼻肠营养导管注册产品的适用范围、禁忌证
1.1适用范围
医疗器械注册申请人应当明确产品的适用范围,其描述应与申报产品的性能、功能相符,并应与临床评价资料结论一致。如:用于经鼻向胃肠道引入营养液等。部分可实现冲洗等其他辅助功能。
1.2预期使用环境
明确该产品预期使用的地点,如医疗机构等。可能影响其安全性和有效性的环境条件,如温度、湿度、压力、海拔等。1.3适用人群
适用人群建议说明目标患者人群信息,患者选择标准,重要考虑因素等。
1.4禁忌证:产品材料有过敏史者,食道下段静脉曲张患者、食道出血患者、食道梗阻患者、肠道吸收障碍患者等其他不宜采用经鼻肠营养管饲的患者。
2.经鼻肠营养导管注册产品技术要求及检验报告
2.1经鼻肠营养导管注册产品技术要求
应当按照《医疗器械产品技术要求编写指导原则》的规定编制产品技术要求,技术指标引用标准应当为现行有效版本。
经鼻肠营养导管基本技术性能指标包括但不限于以下内容,申请人可根据产品自身特点,参考相应的国家、行业标准制定产品技术要求,如有不适用条款(包括国家标准、行业标准要求),申请人应在申报资料中说明理由。
2.1.1外观 :经鼻肠营养导管应清洁、无异物,不应有表面缺陷和加工缺陷;导丝头端应圆钝。
2.1.2尺寸:外径、内径、长度及允差等。
应给出产品的示意图。
2.1.3连接件(拉伸性能、液体泄漏)
应符合YY 0483要求。
2.1.4拉伸性能:应符合YY 0483要求。
2.1.5管身刻度的要求。
2.1.6抗弯曲性能。
2.1.7配合性能。
2.1.8耐腐蚀性(若适用)。
2.1.9化学性能。
根据不同材料特性,由企业决定具体的化学性能要求(如:酸碱度、紫外吸光度、还原物质、蒸发残渣、重金属、过氧化物等,具体指标的选择可以参照相应的国家、行业标准及已上市同类产品情况)。用环氧乙烷灭菌的产品应规定环氧乙烷残留量的要求。
2.1.10射线可探测性(也可使用其他定位方式,如:电磁导航等)。
2.1.11产品应无菌。
2.1.12根据产品宣称的技术特点制定的其他性能要求。
耐压性(若适用);
涂层(若适用):摩擦力等;
带球囊的产品应符合YY/T 0817要求。
2.2经鼻肠营养导管注册产品检验报告
提供检验样品型号/规格的选择依据。所检验型号/规格需为能够代表本注册单元内其他型号/规格的典型产品。当申报产品包括多个型号规格,需综合考虑经鼻肠营养导管的原材料、结构组成、包装方式、灭菌方式、生产工艺和预期用途等影响因素。一个型号不能完全覆盖时,应选择其他型号进行相关性能的补充性检测。注意典型型号/规格不一定是临床常用型号/规格。