齿科医疗器械注册产品或许是使用者最多的医疗器械产品之一,在口腔医院、牙科诊断等医疗机构广泛使用。本文为大家带来窝沟封闭剂产品注册要求及审评要点,帮助对注册企业、生产企业,或是使用者更多了解产品基本知识和要求。
齿科医疗器械注册产品或许是使用者最多的医疗器械产品之一,在口腔医院、牙科诊断等医疗机构广泛使用。本文为大家带来窝沟封闭剂产品注册要求及审评要点,帮助对注册企业、生产企业,或是使用者更多了解产品基本知识和要求。
窝沟封闭剂产品注册要求及审评要点:
适用于能预防龋齿,封闭牙齿窝沟点隙,阻断细菌进入和提高牙齿釉质的耐酸蚀性的树脂基窝沟封闭剂产品,产品分类编码17-10-04。不适用于口腔充填修复材料如水门汀类(17-05-01)、复合树脂(17-05-05)类等III类医疗器械。窝沟封闭剂产品分类编码为17-10-04,按照第二类医疗器械进行管理。
1.窝沟封闭剂产品分类及医疗器械注册单元划分
窝沟封闭剂产品按照固化方式不同,可分为两种形式。化学固化型(I型)、外部能量固化型(II型)。外部能量固化型又分为紫外光固化型、可见光固化型。
窝沟封闭剂产品应依据《医疗器械注册单元划分指导原则》划分注册单元。划分时应遵循以下基本原则:
1.1固化方式不同的产品应划分为不同的注册单元。如化学固化型与光固化型产品应划分为不同的注册单元。
1.2主要组成成分不同的产品应划分为不同的注册单元。但对于主要组成成分相同,仅着色剂不同的各型号产品可划分到同一注册单元,着色剂应符合相关规定。
2.窝沟封闭剂主要组成成分及工作原理
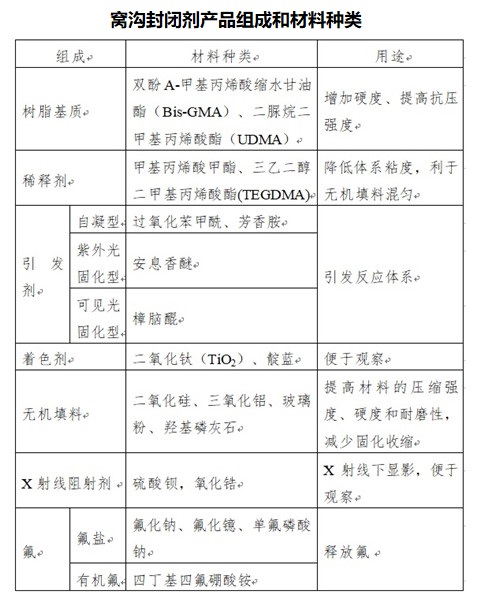
2.1树脂基窝沟封闭剂一般由合成有机高分子树脂基质、稀释剂(单体)、引发剂、着色剂、无机填料组分,部分产品也会添加X射线阻射剂、氟盐或有机氟。
2.2产品工作原理/作用机理
2.2产品固化机理
2.2.1化学固化型
树脂基质和催化剂混合后,在催化剂作用下发生化学反应,固化完成。
2.2.2外部能量固化型
光引发剂在特定波长和强度的光线照射下,产生自由基,引发单体聚合,交联形成聚合物。
2.3窝沟封闭剂产品工作原理
将窝沟封闭材料涂布在牙冠的咬合面和颊舌面之间的窝沟间隙,渗入到窝沟后,逐渐固化变硬,建立一层屏障,保护牙釉质不受细菌及其代谢产物、食物残渣的侵蚀。另外,由于形成了局部密闭环境,促使残存的细菌凋亡,进而有效防止出现窝沟龋以及继发龋。
组成成分中包含氟的窝沟封闭剂产品除了能建立一层保护屏障外,还能利用氟与牙齿结构中羟基磷灰石结合的特性,提高牙釉质的硬度和抗酸能力,减少菌斑的形成并减少龋齿的发病率。
3.产品的适用范围和禁忌证
3.1适用范围/预期用途:用于封闭牙齿窝沟点隙,预防牙齿窝沟点隙处龋齿的形成。说明预期与其组合使用的器械,如牙科输送头、光固化型窝沟封闭剂应明确对光固化灯的波长及强度要求。
3.2预期使用环境:明确该产品预期使用的地点如医疗机构,说明可能会影响其安全性和有效性的环境条件,如光固化型窝沟封闭剂对环境中光线的特殊要求。
3.3适用人群:适用于拥有完好和初期龋坏牙齿的幼儿、儿童,明显的龋齿应选用其他适用的方式治疗。应根据患儿年龄来选择做窝沟封闭的牙齿位置,一般做窝沟封闭的最佳时间为:乳磨牙3~4岁,第一恒磨牙7~9岁,第二恒磨牙11~13岁,双尖牙9~13岁,另外对口腔卫生不良的儿童,虽然年龄较大或萌出时间较久,可考虑放宽窝沟封闭年龄。
3.4禁忌证应包括该产品不适用的疾病、情况及特定的人群等,如对产品成分过敏者禁用。
4.窝沟封闭剂产品技术要求
4.1产品技术要求应包括的主要性能指标
产品技术要求的制定应符合《医疗器械产品技术要求编写指导原则》的要求。申请人应根据产品的技术特征和临床使用情况来确定产品安全、有效的技术指标与检验方法。本指导原则给出窝沟封闭剂需要考虑的产品基本技术性能指标,但并未给出定量要求,可依据YY 0622制定,且性能指标不得低于强制性国家标准、行业标准。产品化学成分可在产品技术要求附录予以明确。
窝沟封闭剂产品的主要性能指标包括:一般性能、各组分的外观、固化的封闭剂、物理性能(I型封闭剂的工作时间、I型封闭剂的固化时间、II型封闭剂对环境光线的敏感性、II型封闭剂的固化时间、II封闭剂的固化深度、未固化膜的厚度)。
对于含氟类产品,若申请人声称组分中的氟在实现产品预期用途中发挥一定的作用,那么应将氟释放特性作为一项性能指标在产品技术要求中予以明确。
此外,若申请人声称产品具有X射线阻射性能,建议将该指标在产品技术要求附录中明确。
4.2同一医疗器械注册单元内注册检验用典型产品确定原则和实例
同一医疗器械注册单元内所检验的型号产品应当能够代表本注册单元内其他型号产品的安全性和有效性。若一个型号不能覆盖,除选择典型性型号进行全性能检验外,还应选择其他型号进行差异性检验。