参考FDA的SC上市审批路径,2017年下半年起,同品种比对临床评价在我国医疗器械上市审批也更广泛认可,越来越多针对具体产品的同品种比对临床评价指导文件出台。
髋关节假体同品种临床评价技术审评要点
本审评要点旨在指导注册申请人对髋关节假体产品注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本审评要点是对髋关节假体产品的临床评价要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
一、适用范围
本审评要点适用于常规设计的髋关节假体同品种临床评价,按现行《医疗器械分类目录》,该类产品分类编码为13-04-01,管理类别为III类。。常规设计的髋关节假体通常由髋臼杯、髋臼内衬、股骨球头、股骨柄组成,具体包括:
由符合GB/T19701标准的普通超高分子量聚乙烯、符合YYT0811标准的高交联超高分子量聚乙烯或符合YY/T 1294标准的陶瓷材料制成的髋臼内衬;由符合YY/T0117.3标准的铸造钴铬钼、符合YY/T0605-12标准的锻造钴铬钼或符合GB/T13810标准的TC4和TC4ELI合金制成的髋臼杯组件;由分别符合YY/T0605-9标准的高氮不锈钢、符合YY/T0117.3标准的铸造钴铬钼、符合YY/T0605-12标准的锻造钴铬钼或符合GB/T13810标准的TC4、TC4ELI和TC20制成的股骨柄组件;由符合YY/T0605-9标准的高氮不锈钢、符合YY/T0117.3标准的铸造钴铬钼、符合YY/T0605-12标准的锻造钴铬钼或符合YY/T 1294标准的陶瓷材料制成的股骨头,由纯钛或钙磷陶瓷制成的涂层。不包括新材料、特殊设计的髋关节假体和定制髋关节假体等。
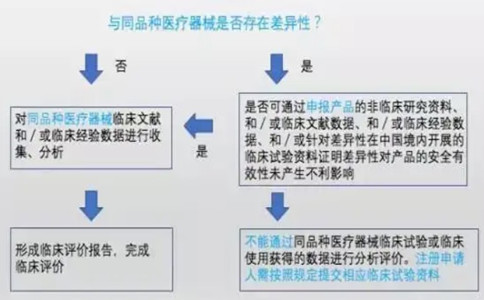
与境内已上市产品相比,申报产品如具有全新的技术特性(如采用了全新的工作原理、技术、材质、结构设计、表面处理、手术方式等),或具有全新的临床适用范围,已有数据无法证明拟申报产品安全有效的,可考虑通过临床试验来获得临床数据。
二、同品种临床评价的基本要求
(一)同品种医疗器械的选择
注册申请人通过同品种比对方式开展髋关节假体的临床评价时,可选用一个或多个同品种医疗器械进行比对,宜优先选择与申报产品适用范围相同、技术特征相同或尽可能相似的产品作为同品种医疗器械。申报产品与同品种医疗器械技术特征差异越大,论证差异对安全有效性的影响难度越大。例如,材料牌号不同对产品性能影响较大,建议选择相同牌号材料产品作为同品种医疗器械。
(二)适用范围及临床使用相关信息的对比
明确适用范围以及临床使用相关信息的相同性和差异性,建议重点考虑以下内容对比(包括但不限于):
1.适应证,如骨性关节炎、类风湿关节炎、创伤性关节炎、股骨头坏死、股骨颈骨折、先天性髋臼发育不良伴骨关节炎或关节脱位、股骨近端肿瘤需切除股骨头和股骨颈的情形等;
2.适用人群,如年龄等;
3.疾病的严重程度和阶段,如适用的骨质条件(如Dorr分型)、先天性髋臼发育不良分级、股骨头坏死程度等;
4.使用方法,如适用的手术入路等;
5.禁忌证、警告及预防措施
6.其他,如表面置换、全髋/半髋置换、初次/翻修等。
(三)技术特征的对比
申报产品与同品种医疗器械技术特征对比着重关注以下对比内容,包括但不限于:
1.产品组成
注册申请人需提供申报产品与同品种医疗器械组件信息对比,明确产品的组成部件,以及预期配合的组件信息。
2.产品设计和关键尺寸
注册申请人需提供申报产品与同品种医疗器械结构特征和关键尺寸对比,可采用结构图、关键尺寸列表和文字描述等方式,尺寸标注可参考YY/T 0809.1标准。需注意YY/T 0809.1标准仅标注了一般性的结构尺寸,注册申请人还需结合产品具体设计提供特征结构和关键尺寸对比,如涂层区域、髋臼杯和内衬锁定设计、股骨柄横截面形状、裙摆设计等。
3.材料性能
注册申请人需对比申报产品和同品种医疗器械各组件的材料牌号及材料性能,并论述生产工艺对材料性能的影响。当申报产品和同品种医疗器械的材料牌号相同,且所用材料均符合相应的国家标准、行业标准或国际标准等公认标准,相应标准中规定了材料性能的接受限值时,申报产品的材料性满足相应标准的要求即可,可不再与同品种医疗器械进行材料性能测试对比,如符合GB/T19701标准要求的超高分子量聚乙烯,符合YY/T0605-9标准的高氮不锈钢,符合GB/T13810标准的TC4、TC4ELI和TC20,符合YY/T0117.3标准的铸造钴铬钼和符合YY/T0605-12标准的锻造钴铬钼等。
对于高交联超高分子量聚乙烯制成的髋臼内衬,对于压缩模量、热性能(结晶度、熔点)、疲劳裂纹扩展、溶胀度、氧化指数、反式亚乙烯指数、自由基浓度、氧化稳定性等材料性能,应开展研究,对研究结果的临床可接受性应有充分的论证,与同品种医疗器械进行对比有助于评估结果临床可接受性。若拉伸性能、抗冲击性能满足GB/T19701标准要求,上述两项性能可不再与同品种医疗器械进行测试对比。
4.产品性能
常规设计的髋关节假体产品性能主要包括股骨柄疲劳性能、髋臼杯抗变形性能、关节面磨损性能、涂层性能、髋臼杯与内衬锁定性能、球头与股骨柄锥连接性能、髋关节假体活动范围等。
(1)股骨柄疲劳性能
股骨柄疲劳性能包括颈部和柄部疲劳性能,建议参照YY0118标准提及的方法开展试验。考虑到相应标准规定了股骨柄疲劳性能的接受限值,申报产品疲劳性能满足标准要求即可,一般不再要求与同品种医疗器械进行测试对比。
(2)髋臼杯抗变形性能
建议参照YY∕T 0809.12标准开展测试,提供申报产品与同品种医疗器械的测试对比。
若申报产品与注册申请人境内已上市的髋关节假体产品相比,髋臼杯设计无任何变化,即原材料、结构尺寸、工艺和质控要求完全相同,可提供相应支持性资料,或髋臼杯设计不会改变抗变形性能或会增强抗变形性能,可提供充分的论证,不需与同品种医疗器械进行测试对比。
(3)磨损性能
注册申请人应提供申报产品髋臼组件与预期配合使用股骨组件形成的关节面的磨损性能资料,并与同品种医疗器械在相同试验方法下的进行磨损性能对比。进行磨损性能对比时,同品种医疗器械的关节面材料与申报产品需尽可能相同;若存在差异,需阐明同品种医疗器械的选择依据。推荐采用YY/T 0651、ISO 14242、ISO 17853等标准中的测试方法和参数。磨损性能的对比建议包括磨损率、磨损量-时间曲线、肉眼和显微镜下磨损试验前后关节面形貌等。若为新型关节面材料,还需对磨屑粒径大小、形貌、生物相容性进行研究。
(4)生物型股骨柄和髋臼杯的涂层性能
生物型股骨柄和髋臼杯常见的涂层材料包括纯钛和钙磷陶瓷等,常见的涂层工艺包括等离子喷涂、烧结和电泳沉积等。不同涂层材料和工艺形成的涂层微观结构、力学性能和骨结合性能不同,因此建议尽可能选择具有相同涂层材料和工艺的产品作为同品种医疗器械。
需对比申报产品与同品种医疗器械的涂层性能和微观结构。涂层性能包括涂层与基体材料间的力学性能(如拉伸强度、动静态剪切强度等)和磨损性能。涂层微观结构主要包括涂层厚度、形貌、粗糙度、孔隙率、平均空隙截距等,具体需对比项目与涂层类型相适应,例如,对于等离子喷涂涂层,应至少包括形貌图、厚度、孔隙率、平均空隙截距等;对于髋臼杯外表面3D打印多孔结构,微观结构至少应包括形貌图、丝径、最小打印单元结构、孔隙率、孔径、孔隙渐变梯度、内部连通性等。考虑到YY0118标准规定了等离子喷涂金属涂层磨损性能的接受限值,申报产品满足标准要求即可,一般不再要求与同品种医疗器械进行测试对比。
若申报产品股骨柄和髋臼杯的涂层与注册申请人境内已上市的髋关节假体相比,基底材料、涂层材料、涂层工艺、及其质控要求均未发生改变,可充分表征申报产品的涂层性能和微观结构,提供涂层未发生变化的支持性资料,不再需要与同品种医疗器械进行测试对比。
(5)髋臼杯与聚乙烯内衬锁定性能
髋臼杯和衬垫通常为机械锁定,需对比申报产品与同品种医疗器械的锁定性能,包括轴向推出试验、撬出试验、旋转分离试验等。
若申报产品与注册申请人境内已上市的髋关节假体产品相比,髋臼杯内衬机械锁定设计无任何变化,即原材料、结构尺寸、工艺和质控要求完全相同,可提供相应支持性资料,不需与同品种医疗器械进行测试对比。
(6)金属球头锥连接性能
若申报产品组件含有锥连接(如球头与股骨柄、模块式股骨柄组件间),需提供申报产品与同品种医疗器械锥连接性能的对比资料,如抗拔出性能、抗扭矩性能等。
若申报产品与注册申请人境内已上市的髋关节假体产品相比,锥连接设计无任何变化,即原材料、结构尺寸、工艺和质控要求完全相同,可提供相应支持性资料,不需与同品种医疗器械进行测试对比。
(7)陶瓷球头与陶瓷内衬组件性能
陶瓷球头需与配合使用的股骨部件进行破碎试验、疲劳试验、疲劳后破碎试验、脱出试验、扭矩试验,陶瓷内衬需与配合使用的髋臼外杯、股骨部件进行破碎试验、疲劳试验、疲劳后破碎试验、压出试验、扭矩试验和撬出试验。注册申请人可将上述试验结果与同品种医疗器械进行比较,也可根据公认的接受限值论述试验结果的可接受性。
(8)活动范围
建议参照YY0118标准提及的方法开展试验。考虑到相应标准规定了活动范围的接受限值,申报产品活动范围满足标准要求即可,一般不再要求与同品种医疗器械进行测试对比
(9)其他
注册申请人需选择各组件最差情形作为测试样品,最差情况指在性能测试中预期表现最差的规格。结构设计差异显著,难以论证最差情况的组件建议分别开展测试。
在与同品种医疗器械进行性能对比时,测试方法和参数应相同,注册申请人应在对比表中列明申报产品与同品种医疗器械的测试方法和结果数据。
若存在相应测试标准,建议采取标准规定的测试方法和参数进行测试,若自行设计测试方法或改变标准中的测试参数,需提供测试方法和参数的合理依据,同时与同品种医疗器械开展测试对比。
(四)论证差异不对安全有效性产生不利影响
1.产品设计和关键尺寸
注册申请人需明确申报产品与同品种医疗器械结构尺寸的相同性和差异性,并论述差异对产品安全有效性的影响。不同的结构尺寸差异对安全有效性的影响不同,评价差异对安全有效性影响的方法亦不相同。
部分结构尺寸差异通过分析可论证其不对安全有效性产生不利影响。例如,近端固定生物型股骨柄在同品种医疗器械基础上增加了远端开槽设计,开槽位置位于远端且长度较小,经过充分分析发现其不影响柄身力学性能,亦不影响股骨柄初始和长期固定稳定性,论证该差异不对申报产品安全有效性产生不利影响。
部分结构尺寸差异需通过力学试验论证其不对安全有效性产生不利影响。例如,锥连接结构尺寸存在差异,若该差异仅影响股骨柄和球头连接性能,此时可开展锥连接与球头连接力学试验,若结果显示申报产品不差于同品种医疗器械,则可证明该结构尺寸差异不对申报产品安全有效性产生不利影响。
部分结构尺寸差异需增加具有相似或相同设计的已上市产品作为同品种医疗器械,以论证其不对安全有效性产生不利影响。例如,若申报产品存在与所选同品种医疗器械不同设计型号时,可增加同品种医疗器械以证明该设计型号的安全有效性。
2.材料性能
若申报产品与同品种医疗器械材料牌号不同,建议增加相同牌号材料同品种医疗器械进行测试对比。
3.产品性能
若申报产品性能优于或与同品种医疗器械相当,可为申报产品与同品种医疗器械具有相同的安全有效提供科学证据。若申报产品部分力学性能低于同品种医疗器械,注册申请人需分析申报产品力学性能较低的原因,可通过对产品进行设计变更以提高产品的力学性能。若注册申请人降低申报产品部分力学性能,以获取其他方面的临床受益,需从临床风险和受益的角度论述力学性能降低后仍可以接受的充分理由及证据,申报产品临床数据可为产品临床风险受益提供证据。
论证涂层微观结构对体内骨整合效果的影响通常较难,若难以论证微观结构差异对骨整合的影响,可考虑增加具有相同涂层的同品种医疗器械,或通过动物试验予以论证。
三、同品种医疗器械的临床数据
建议优先选择具有长期临床安全应用史的产品作为同品种医疗器械。该类产品积累了较多的临床数据,含有较多公开的临床数据,如临床文献和登记数据库数据,亦包括较多的中长期临床数据,其在真实的临床实践环境中的安全有效性较为确切。
髋关节假体同品种医疗器械的临床数据常包括临床文献数据、登记数据库数据、不良事件数据等类型,注册申请人也可通过同品种医疗器械企业授权获取临床试验数据。鼓励使用良好治理的各国关节数据登记数据库中的数据,相较于其他类型数据,该数据具有人群覆盖面大、随访时间长等优势,可用于评价髋关节假体系统的中远期安全有效性。登记数据库数据呈现注意明确不同时间点的累计翻修率及其95%置信区间、假体植入例数、翻修例数、累计观察年、最短最长观察年等。
考虑到髋关节假体数据来源的多样性,建议注册申请人提取关键要素,以图表形式呈现数据,以附件的形式提供数据来源的原文件和/或原文。
(一)有效性数据
对于髋关节假体,有效性临床数据可参考以下关键要素提取数据:
1.患者信息:性别、年龄、诊断、骨质情况、伴随疾病以及其他影响临床结局的特征等;
2.产品信息:产品名称、型号规格;
3.研究设计:设计类型、样本量、研究证据等级;
4.评价指标:提取各时间点(包括术前、术后各随访点)评价指标数据,包括但不限于生存率或翻修率、功能性评分、活动范围和生活质量评分等。相关的功能性评分包括Harris评分、Oxford评分、Charnley评分、HHS评分、Merle D’Aubigne评分、VAS评分、SF-36/SF-12评分、HOOS评分、Q-5D评分、牛津评分、WOMAC评分、UCLA活动评分等。
如上所述,髋关节假体产品有效性评价指标种类较多,在收集和分析同品种医疗器械有效性数据时,应分别对各评价指标数据进行汇总分析,适用时开展荟萃分析。
(二)安全性数据
常见的髋关节假体不良事件包括脱位、假体周围骨折、松动、骨溶解、感染、下肢不等长、大腿疼、粗隆不愈合、活动范围受限等。髋关节假体安全性数据常来源于各国不良事件数据库、召回数据库和临床文献,不良事件数据库包括各国药监局的不良事件数据库、企业自身的不良事件数据库、医院的不良事件数据库和第三方商业公司或协会组织运行的不良事件数据库。针对不良事件,应以表格的形式提供各国上市时间、销售数量(如可获取)、不良事件类别及数量、与产品相关性、事件描述、原因分析、处理方式和处理结果等具体信息。
附录:可参考的指导原则
1 | 《医疗器械临床评价技术指导原则》(2021年第73号通告) |
2 | 《医疗器械临床评价等同性论证技术指导原则》(2021年第73号通告) |
3 | 《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号通告) |
4 | 《髋关节假体系统注册技术审查指导原则》(2017年第23号通告) |