日前,总局医疗器械技术审评中心发布医疗器械注册答疑3项,特别是产品规格尺寸变化后,有条件无需进行医疗器械注册检验的官方答疑,传递的信息非常有价值。
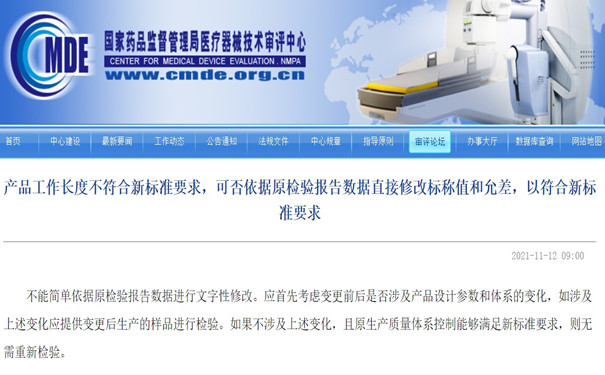
1.产品工作长度不符合新标准要求,可否依据原检验报告数据直接修改标称值和允差,以符合新标准要求工作长度不符合新标准要求,可否依据原检验报告数据直接修改标称值和允差,以符合新标准要求?
不能简单依据原检验报告数据进行文字性修改。应首先考虑变更前后是否涉及产品设计参数和体系的变化,如涉及上述变化应提供变更后生产的样品进行检验。如果不涉及上述变化,且原生产质量体系控制能够满足新标准要求,则无需重新检验。
2.高通量血液透析器产品的清除率检测中β2微球蛋白清除率试验条件,是否可以只设置一个血液流速,不覆盖所有血液流速范围?
根据强制性行业标准YY 0053-2016中3.5.1.2条款规定,高通量血液透析器应在临床常用血液流速下,可以选择单一血液流速,评价β2微球蛋白清除率。
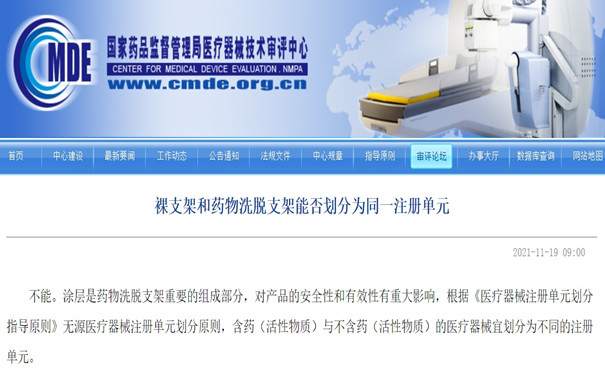
3.裸支架和药物洗脱支架能否划分为同一医疗器械注册单元
不能。涂层是药物洗脱支架重要的组成部分,对产品的安全性和有效性有重大影响,根据《医疗器械注册单元划分指导原则》无源医疗器械注册单元划分原则,含药(活性物质)与不含药(活性物质)的医疗器械宜划分为不同的注册单元。