引言:MDD指令将于2021年失效,对于拟申请医疗器械CE认证的企业来说,取而代之的是面对MDR的要求,本文为您科普什么是MDR。

医疗器械CE认证之MDR简介:
CE为法文CONFORMITE EUROPEENNE的首字母缩写,表示“欧洲统一”。
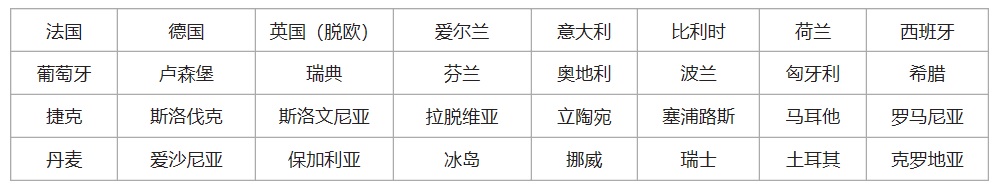
欧盟EU+欧洲自由贸易联盟会员国,英国脱欧后,共有31个国家。
很多除欧盟外的国家,除美国FDA、日本PAL、澳大利亚TGA等,绝大数通行欧洲颁发的自由销售证书CFS。
CE标志是一种安全认证标志,凡贴有CE标志的产品均可在欧盟各成员国内销售,无须符合各个成员国的要求。使用CE标志,实现了商品在欧盟成员国范围内的自由流通,因此CE标志被视为制造商打开并进入欧洲市场的通行证。
在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》法规的基本要求, 加贴“CE”标志必须识别很多协调标准,这是欧盟法律对产品提出的一种强制性要求。
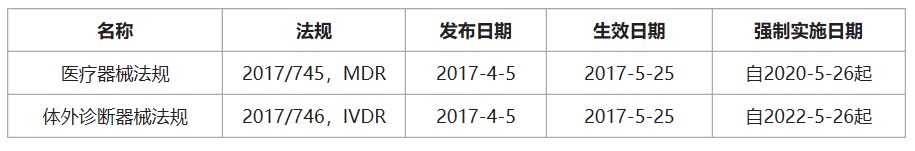
欧盟在2017年4月发布了医疗器械法规(EU)2017/745(MDR),将取代现有的医疗器械指令(MDD)93/42/EEC,自2017年5月25日起生效,医疗器械企业有3年的过渡期(即强制实施日期2020年5月26日)。MDR与MDD存在明显差异。除了其内容多了3倍之外,主要差异包括:包括了有源植入性器械和范围扩大至包含具有美学或非医疗目的但在功能和风险特征方面类似于医疗器械的产品。对于使用纳米材料口服产品的器械有新的分类规则和符合性审核要求。
在本次发布的医疗器械法规(EU)从原先的Directive(指令)上升为Regulation(法规),标志着欧盟当局对医疗设备领域监管的进一步重视,同时也预示着在欧盟各成员国内医疗器械监管的尺度将得到进一步的统一。
医疗器械CE认证之欧盟医疗器械法规:
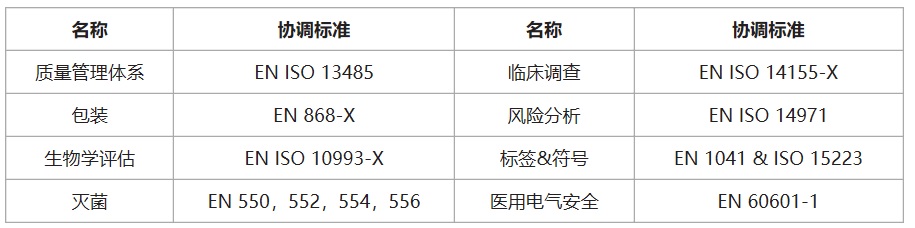
医疗器械CE认证之欧盟医疗器械协调标准:
杭州证标客医药技术咨询有限公司是国内极少数提供医疗器械CE认证、进口医疗器械注册全流程服务的机构之一。有任何需求,欢迎您随时方便联系叶工18058734169(微信同)。