?在内窥镜检查和手术中配合内窥镜使用的无源内窥镜用剪,在我国属于第二类医疗器械注册产品,依据最新适用的《医疗器械分类目录》,其分类编码为02-03-03。近日,国家药监局发布了《内窥镜手术用剪注册审查指导原则(征求意见稿)》,正好带大家了解内窥镜手术用剪产品技术要求及注册审查要点。
在内窥镜检查和手术中配合内窥镜使用的无源内窥镜用剪,在我国属于第二类医疗器械注册产品,依据最新适用的《医疗器械分类目录》,其分类编码为02-03-03。近日,国家药监局发布了《内窥镜手术用剪注册审查指导原则(征求意见稿)》,正好带大家了解内窥镜手术用剪产品技术要求及注册审查要点。
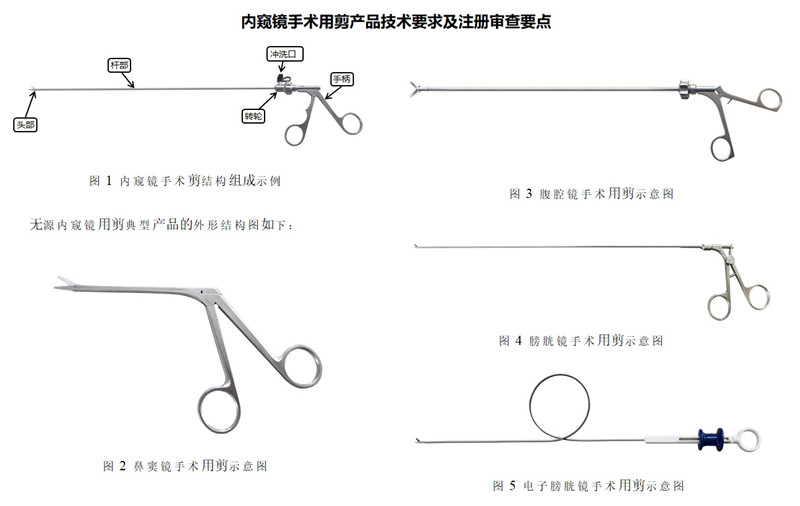
一、内窥镜手术用剪产品注册单元的划分
内窥镜手术用剪产品注册单元划分应符合《医疗器械注册单元划分指导原则》的要求,原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。
产品结构组成、性能指标或加工处理方式不同而导致产品适用范围不同时,原则上划分为不同的注册单元。例如鼻窦镜手术剪与腹腔镜手术剪应划分为不同的注册单元。
一次性使用内窥镜用剪与可重复性使用内窥镜用剪建议划分为不同注册单元。
二、内窥镜手术用剪产品工作原理及产品描述
2.1工作原理
内窥镜手术用剪刀头为一对带刃口的刀片,通过手柄操作传递、控制刀头刀片的运动,供施行内窥镜手术时剪切使用。
2.2原材料
详述产品所用原材料(包括交联剂等任何生产过程中加入的成分及预装器材等)的中文化学名称、化学结构式/分子式、材料商品名(若有)、材料代号/牌号(若有)、符合的标准以及与人体的接触方式。进口产品的材料应与原产国上市证明文件/说明书批准的范围一致。
若刀头带有涂层的,应给出涂层成分、涂层特征及作用、涂层在器械上的位置及涂覆范围、涂层涂覆方式及工艺。考虑灭菌方式对涂层的影响,如涂层对环氧乙烷解析的影响。若涂层对包装有特殊要求,建议明确。一般来说,涂层成分宜为有长期医疗器械安全应用史的化学物质。
2.3交付状态及灭菌方式
以无菌方式提供的内窥镜手术用剪,应描述灭菌实施者、灭菌方法、灭菌有效期。
以非无菌方式提供的内窥镜手术用剪,应明确推荐的清洗、消毒工艺(方法和参数)和灭菌工艺(方法和参数)。
2.4结构组成及功能
提供产品结构示意图和/或产品图示、使用方法以及区别于其他同类产品的特征等内容。结合实物图或示意图,对产品的结构组成进行详尽描述,可给出横截面图(若不同位置横截面不同,应分别给出)、纵剖面图;应给出头端部分放大结构图,明确不同头端形状。体现手柄操作部分、插入部分、头端部分、转轮部分、冲洗口部分等的细节,不同型号产品若不能被典型性型号覆盖,应分别给出结构组成图示。
该产品通常由头部、杆部或软性导管、转轮(若有)、冲洗口(若有)和手柄组成,头部为一对带刃口的刀片,通过手柄操作传递、控制头部工作。一般头部采用不锈钢材料制成。

三、内窥镜手术用剪产品技术要求及性能指标
产品技术要求应至少包括以下内容:
(1)外观
内窥镜手术用剪剪刀头的两片应相互吻合,不得有错位现象,刃面不得有卷刃、崩刃现象,其他部位一般应光滑圆润,表面应无非设计预期的锋棱、裂纹、毛刺等。
内窥镜手术用剪头端部分应经过处理,在内窥镜视野中可见的头端部分无定向反射现象。
(2)尺寸
内窥镜手术用剪应明确产品规格尺寸和公差,应标称器械的工作长度、张开角度、杆部外径等,一般采用图表明示。尺寸允许公差参照可参照行业标准中的相关要求(如YY/T 0672.2)。
(3)硬度
内窥镜手术用剪硬度如有国家标准、行业标准要求,应执行相应标准;如无相应标准要求,注册申请人可根据产品实际情况明确硬度要求,但应满足临床使用要求。
(4)表面粗糙度
内窥镜手术用剪的表面粗糙度如有国家标准、行业标准要求,应按国家标准、行业标准执行;如无相应国家标准、行业标准要求,注册申请人可根据产品实际情况明确表面粗糙度要求,但应满足临床使用要求。
(5)剪切性能
剪刀应有良好的剪切性能,切口光滑并能顺利剪切规定的试验材料,剪切后无纤维拉出现象。
(6)开闭灵活性
剪刀开闭应灵活,不应有咬口、卡滞现象。有转轮功能的,刀头应360°内转向自如。
(7)耐腐蚀性能
内窥镜手术用剪的不锈钢部位外表面的耐腐蚀性能可参考相关标准(如:YY/T 0149)的相关试验方法。其他材料用说明书中指定的灭菌方法灭菌后,应无腐蚀现象。
(8)连接牢固度
内窥镜手术用剪各连接部位应牢固可靠,若有焊接,焊缝应平整光滑,无脱焊或堆焊现象。拆卸、装配应方便,装配后连接部位牢固,无松脱现象。
(9)冲洗接头(如适用)
如冲洗接头采用鲁尔接头,可参考相关标准(如:GB/T 1962.2-2001《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头 第2部分:锁定接头》)的相关试验方法。
(10)通水性能(如适用)
应具有良好的通水性能。
(11)化学性能(如适用)
根据不同材料的特性,申请人应对产品与人体接触部分的高分子材料的化学性能制定相应要求,如酸碱度、重金属总含量、还原物质等。
(12)无菌(如适用)
无菌内窥镜手术用剪经确认的方法灭菌后应无菌。若产品灭菌后可能产生残留,则残留量应符合相关标准要求。
(13)其他
企业对宣称的所有其他技术参数和功能,均应在产品技术要求中予以规定。
如有内窥镜手术用剪产品技术要求或是医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。