为规范境内第三类和进口医疗器械注册相关工作,按照《医疗器械监督管理条例》(国务院令第650号)和《医疗器械注册管理办法》(食品药品监管总局令第4号)要求,食品药品监管总局组织制修订了自行撤回医疗器械注册申请程序(自2016年1月1日起施行)。
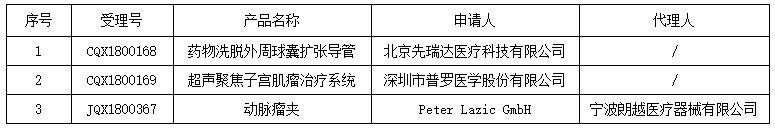
2019年7月16日,国家药品监督管理总局发布自行撤回医疗器械注册申请告知书发布的通知,共涉及3个产品。详情如下:
以下是自行撤回医疗器械注册申请程序:
一、项目名称:自行撤回医疗器械注册申请
二、受理范围:已受理尚未做出行政许可决定前的注册申请。
三、收费依据:不收费
四、办理条件:
由注册人提出申请。
五、申请资料要求:
(一)注册申请人签章的自行撤回申请,申请内容应当清晰、完整;
(二)撤回注册申请项目的受理通知书原件。
(三)具体办理人应提交授权书及该身份证复印件。
六、办理程序:
(一)行政事项受理服务和投诉举报中心经办人按照相应申请资料要求,对自行撤回注册申请资料进行形式审查,对于符合申请资料要求的予以受理。
(二)行政事项受理服务和投诉举报中心自受理后3个工作日内,按照申请事项实际审评审批状态和有关移交程序规定,将申请资料移交总局医疗器械技术审评中心和总局医疗器械注册管理司。
(三)总局医疗器械技术审评中心或总局医疗器械注册管理司核实后终止相关注册资料审评审批,并在电子审评记录上予以标注。总局医疗器械注册管理司应告知总局医疗器械技术审评中心。企业已交纳的注册费用不予退回。
(四)总局医疗器械技术审评中心复印医疗器械注册申报资料,将复印件归档,原件退还注册申请人。