内窥镜刮匙手术中在内窥镜下操作,用于刮除/采集组织。根据《医疗器械分类目录》,内窥镜刮匙在我国按照第二类医疗器械注册管理,内窥镜刮匙通常由头部、杆部或软性导管和手柄组成,其分类编码为02-09-02。本文为大家介绍内窥镜刮匙产品技术要求和医疗器械注册要点,一起看正文。
内窥镜刮匙手术中在内窥镜下操作,用于刮除/采集组织。根据《医疗器械分类目录》,内窥镜刮匙在我国按照第二类医疗器械注册管理,内窥镜刮匙通常由头部、杆部或软性导管和手柄组成,其分类编码为02-09-02。本文为大家介绍内窥镜刮匙产品技术要求和医疗器械注册要点,一起看正文。
内窥镜刮匙产品技术要求和医疗器械注册要点
1.内窥镜刮匙工作原理
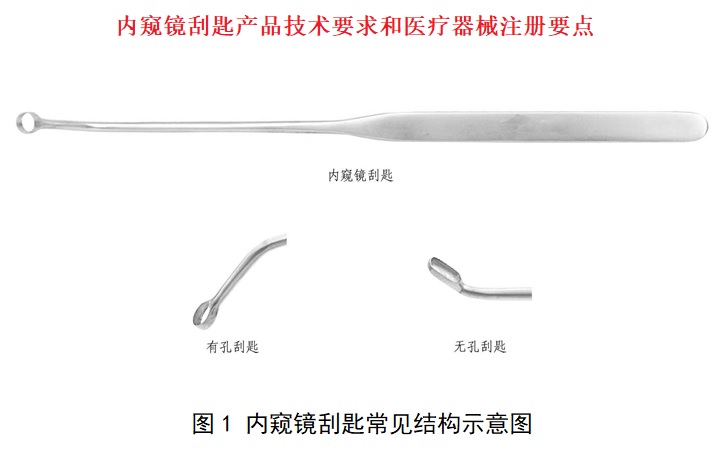
通常由头部、杆部或软性导管和手柄组成,头部为匙形,通过手柄操作传递、控制头部工作,在内窥镜手术中用于刮除/采集组织。一般头部采用不锈钢材料制成。可提供产品结构示意图和/或产品图示。
2.内窥镜刮匙产品技术要求
医疗器械注册申请人应按照《医疗器械产品技术要求编写指导原则》并结合产品的技术特征和临床使用情况来编制技术要求,参考标准YY/T 1297《医用内窥镜 内窥镜器械 刮匙》适用条款制定产品的性能指标要求。
(1)产品型号/规格及其划分说明
明确产品型号/规格,阐明各型号/规格间的区别及划分说明,型号/规格的表述应与全部注册申报资料保持一致,并建议提供结构示意图。
(2)性能指标
产品性能指标通常包括但不限于以下项目:
外观
形状与尺寸(插入部分最大宽度、工作长度、刮头形状与尺寸)
刚度(若适用)
连接强度
表面粗糙度
硬度
旋转性能(具有旋转功能的适用)
耐受性(非一次性使用的产品适用)
耐腐蚀性能
无菌(如适用)
鲁尔接头(如适用)
通水/通气性能(如适用)
化学性能:根据不同材料的特性,申请人应对产品与人体接触部分的聚合物材料的化学性能制定相应要求,如酸碱度、重金属总含量、还原物质(易氧化物)等;使用环氧乙烷灭菌的产品应规定环氧乙烷残留量的要求。
若申请人声称具有其他特定的技术特性的,应制订相应的性能指标。
如适用的国家标准或行业标准中对产品各性能指标有明确的检验方法,建议优先选择作为各性能指标对应的检验方法。
(3)检验方法
产品的检验方法需优先采用国家标准/行业标准中的方法。对于相关国家标准/行业标准中不适用的条款,需说明不适用的原因。所有引用的标准注明其编号和年代号。必要时可以附录形式采用相应图示进行说明,文本较大的可以附录形式提供。
3.内窥镜刮匙适用范围与禁忌症
3.1适用范围
3.1.1应当描述申报产品的适用范围,明确预期用途。内窥镜刮匙手术中在内窥镜下操作,用于刮除/采集组织。
3.1.2明确目标用户及其操作或使用该产品应当具备的技能/知识/培训。明确产品为一次性使用或重复使用。
3.2预期使用环境
应明确申报产品使用场所要求,如医疗机构等。
3.3适用人群
应详述申报产品的适用人群。
3.4 禁忌证
应说明该产品禁忌应用的疾病、部位、人群等。如:对原材料过敏者禁用。
如有内窥镜刮匙产品技术要求、内窥镜刮匙注册、医疗器械注册咨询服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:吕工,电话:18058734169,微信同。