在中国, MitraClip System经导管二尖瓣夹及可操控导引导管主要通过提交境外临床试验数据进行临床评价,还补充了来自文献的中国人群、亚太人群的临床经验数据,并于2020年6月15日和2021年4月20日获批。
在中国, MitraClip System经导管二尖瓣夹及可操控导引导管主要通过提交境外临床试验数据进行临床评价,还补充了来自文献的中国人群、亚太人群的临床经验数据,并于2020年6月15日和2021年4月20日获批。
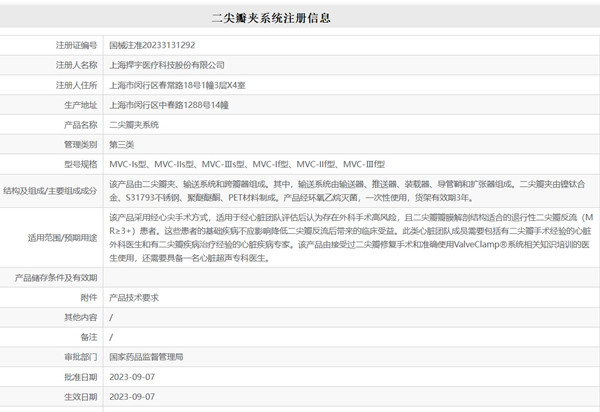
上海捍宇医疗科技股份有限公司的二尖瓣夹系统于2023年8月31日批准上市,该产品通过经心尖介入治疗方式将二尖瓣夹输送至二尖瓣瓣叶处,二尖瓣夹经超声引导定位并夹持住二尖瓣的前叶和后叶,使瓣叶紧密对接,然后操作输送系统释放二尖瓣夹,从而达到降低二尖瓣反流的目的。该产品通过临床试验路径进行临床评价,采用前瞻性、多中心、单组目标值的试验设计,以验证该产品的安全性及有效性。试验共入组 102 例受试者。有效性评价指标包括术后 360 天时产品有效率(无死亡、无二尖瓣瓣膜再次手术发生率,二尖瓣反流(MR)≤2级),术后即刻、术后 30 天、术后180 天产品有效率(无死亡、无二尖瓣瓣膜再次手术发生率,MR≤2 级)。安全性评价指标包括术后即刻、出院前及 30 天、180 天和 360 天收集并评价以下指标:通过超声等记录的夹合部位发生的不良事件、患者 NYHA 心功能分级、实验室检查异常及判断说明等。该临床试验于2019年启动,当时国内尚无同类产品上市,因此无法使用阳性器械进行对照。该产品适用于经心脏团队评估后认为存在外科手术高风险的患者,因此也无法以外科手术作为对照组。
根据现有经导管二尖瓣夹系统的适用范围和设计特征,对该类器械的临床试验设计提出如下建议:
(一)对于适用于经心脏团队评估后认为存在外科手术高风险,且二尖瓣瓣膜解剖结构适合的退行性二尖瓣反流(MR≥3+)患者的二尖瓣夹合器系统,如参考《医疗器械临床试验设计指导原则》有合理理由可选择单组设计时,考虑到单组设计实质是将主要评价指标的试验结果与已有临床数据进行比较,以评价试验器械的有效性/安全性,存在非同期对照偏倚,包括选择偏倚、混杂偏倚、测量偏倚和评价偏倚等,因此申请人在选择单组设计时应重点关注如下内容:
1.试验器械的适用人群、主要评价指标(如观察方法、随访时间、判定标准等)需被充分定义且稳定,并采取充分的偏倚控制措施。需设置恰当的入排标准,入选标准需保障受试人群对预期使用人群的代表性,排除标准旨在尽可能规范受试者的同质性。临床试验的主要有效性终点建议为术后 12个月产品有效率(无死亡、无二尖瓣瓣膜再次手术发生,二尖瓣反流(MR)≤2级),主要安全性终点建议设为30天内的MAEs发生率。次要评价指标建议考虑:术后6个月和12个月的MAEs发生率、术后30天和6个月的产品有效率、NYHA心功能分级、SF36测量的生活质量、6分钟步行测试、左心室功能(LVEF左室射血分数、LVEDV左室舒张末容积、LVESV左室收缩末容积、LVIDs左室收缩末内径、LVIDd左室舒张末内径)和心衰再住院情况等。
2.目标值的设定需依据充分的循证医学证据,全面收集具有高质量水平及相当数量病例的临床研究数据,并进行科学分析(如Meta分析)。由于单组设计可能存在选择偏倚、混杂偏倚等问题,申请人应详细比对临床试验与用于目标值构建的临床研究数据的患者基线数据,以及各评价指标定义的一致性(如MAEs和“有效”的定义)。由于单组目标值试验无法确证试验器械的优效、等效或非劣效,仅能确证试验器械的有效性/安全性达到专业领域内公认的最低标准,因此,确定的目标值需科学、客观,包括靶值和单侧置信区间界限,确保临床试验可基于充分的样本量得出产品安全、有效的结论。
(二)对于适用于使用最大剂量的指南导向药物治疗后仍有症状的中重度或重度继发性二尖瓣反流患者的二尖瓣夹合器系统,申请人需开展随机对照试验,可选取仅接受指南导向药物治疗(GDMT)或阳性器械作为对照组。
如有医疗器械临床试验服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。