作为国内最早成功辅导企业采用医疗器械注册人制度?完成产品注册的第三方医疗器械咨询公司之一,作为辅导浙江省首2家采用医疗器械注册人制度并顺利通过体考的第三方医疗器械咨询公司,杭州证标客医药技术咨询有限公司带大家一起来了解MAH制度下,体系考核注意事项。
作为国内最早成功辅导企业采用医疗器械注册人制度完成产品注册的第三方医疗器械咨询公司之一,作为辅导浙江省首2家采用医疗器械注册人制度并顺利通过体考的第三方医疗器械咨询公司,杭州证标客医药技术咨询有限公司带大家一起来了解MAH制度下,体系考核注意事项。
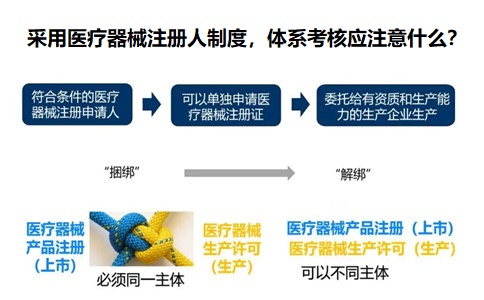
采用医疗器械注册人制度,体系考核应注意什么?
委托生产前,医疗器械注册申请人应当对受托生产企业的质量管理体系开展现场评估审核,审核内容至少应当包括机构和人员、厂房与设施、设备、生产管理、质量控制能力等,确保受托生产企业具备与受托生产产品相适应的质量管理体系。
申请人应当定期对受托生产企业的受托生产管理情况和相关记录进行审核,并保留审核记录。受托生产企业应当保留受托生产相关的全部生产记录,并可随时提供给申请人备查。如果受托生产企业有相同产品在生产,应当与受托生产产品有显著区别的编号、批号及过程标识管理方式,避免混淆。