进口第一类医疗器械产品备案流程和要求
发布日期:2021-12-07 00:00浏览次数:4306次
《医疗器械监督管理条例》(国务院令第650号)第十条规定:向我国境内出口第一类医疗器械的境外生产企业,由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。备案资料载明的事项发生变化的,应当向原备案部门变更备案。这是我国对进口第一类医疗器械产品备案的法规要求。
《医疗器械监督管理条例》第十条规定:向我国境内出口第一类医疗器械的境外生产企业,由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。备案资料载明的事项发生变化的,应当向原备案部门变更备案。这是我国对进口第一类医疗器械产品备案的法规要求。
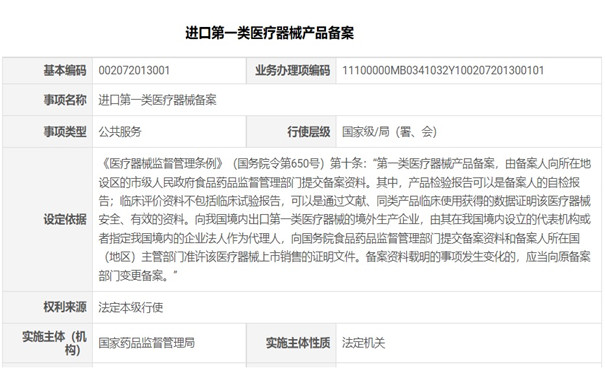
一、进口第一类医疗器械产品备案流程说明:
备案人应当按照《国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告》(2014年第26号)的规定提交资料。备案事项属于本部门职权范围,备案资料齐全、符合形式要求的,当场予以备案,并提供备案人加盖本部门专有印章的备案凭证,将备案信息表中登载的信息在国家药监局网站上予以公布。备案资料不齐全或者不符合规定形式的,应当一次告知需要补正的全部内容,对不予备案的,应当告知备案人并说明理由。
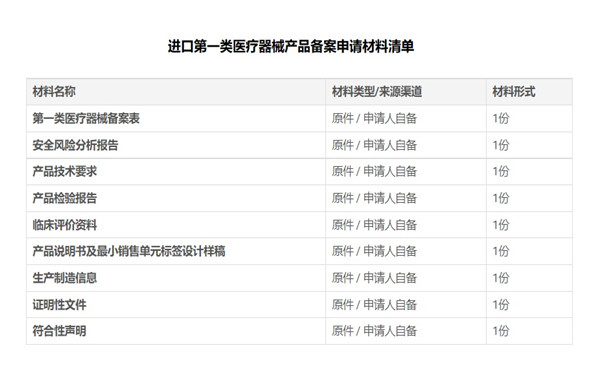
二、进口第一类医疗器械产品备案材料:
任何有关进口第一类医疗器械产品备案需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司叶工联系,电话:18058734169,微信同。