引言:2020年12月18日,药监总局发布2项医疗器械注册答疑,详见正文。
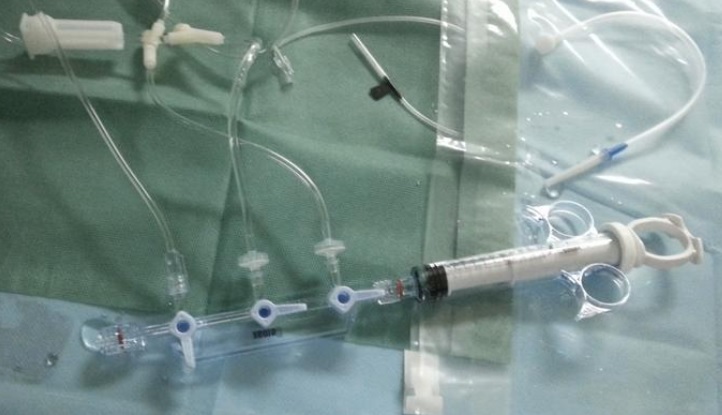
一、对血管内造影导管的动力注射要求有哪些:
1)对于采用高压注射装置注射的造影导管产品,需在技术要求和说明书(标签)中标注最大爆破压力信息,同时按照YY0285.1-2017对动力注射要求进行规定。
2)对于采用环柄注射器注射造影剂的造影导管产品,可不制定动力注射要求。宜在说明书中明确以下警示:请勿使用高压注射装置注射造影剂。
适用范围中包含血管造影功能的其他导管,宜参照以上要求。
二、体外诊断设备说明书发生变化该怎么办:
根据《医疗器械说明书和标签管理规定》(6号令)第十六条规定:“已注册的医疗器械发生注册变更的,申请人应当在取得变更文件后,依据变更文件自行修改说明书和标签。说明书的其他内容发生变化的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。”